Table des matières
Introduction : L'importance de la stabilité des protéines
La compréhension de la stabilité des protéines est fondamentale pour la biochimie moderne, la recherche pharmaceutique et la biotechnologie. La stabilité des protéines détermine non seulement la durée pendant laquelle une protéine thérapeutique peut rester active en solution, mais aussi son aptitude à la formulation, au stockage et au transport (Wang 1999). De l’ingénierie enzymatique au développement de médicaments et aux études de biologie structurale, la capacité d’évaluer avec précision et d’optimiser la stabilité des protéines permet aux chercheurs et aux innovateurs de faire progresser les applications des sciences de la vie tout en minimisant les risques dus à l’agrégation, à la dénaturation ou à la perte d’activité.
Des publications récentes soulignent le rôle de la stabilité des protéines dans la formulation des médicaments et les bioprocédés, où même de petites modifications de la composition du tampon ou de la température peuvent affecter profondément le pliage des protéines et les résultats thérapeutiques (Durowoju et al. 2017).
Facteurs influençant la stabilité des protéines
La fonction des protéines dépend de façon critique de l’intégrité de leur structure tridimensionnelle, la conformation native. Cette structure peut être perturbée par divers facteurs physico-chimiques :
- Température: Les températures élevées peuvent déplier les protéines, entraînant une perte de fonction irréversible ou une agrégation.
- Le pH: Les changements de pH perturbent les interactions ioniques et les liaisons hydrogène, ce qui a un impact sur la stabilité structurelle.
- La force ionique: Les sels peuvent stabiliser ou déstabiliser les protéines en fonction d’interactions spécifiques avec les chaînes latérales chargées.
- Liaison avec un ligand: Les petites molécules, les cofacteurs ou les médicaments qui se lient aux protéines peuvent stabiliser ou déstabiliser des conformations spécifiques (Durowoju et al. 2017).
- Mutations génétiques: Les mutations ponctuelles peuvent améliorer ou réduire la stabilité, influençant ainsi le comportement de la protéine dans des conditions physiologiques.
Des études systématiques révèlent que l’ajustement de la chimie des tampons et le contrôle de la température pendant la manipulation et le stockage sont parmi les interventions les plus efficaces pour préserver l’activité des protéines (Wang 1999).
Principes fondamentaux : Que signifie la stabilité des protéines ?
La stabilité des protéines fait référence à la résistance de la structure native d’une protéine dans diverses conditions. Elle englobe :
- Stabilité thermodynamique: La tendance d’une protéine à rester pliée plutôt qu’à se dénaturer.
- Stabilité cinétique: La vitesse à laquelle une protéine passe à un état déplié ou agrégé.
- Changements réversibles: Certaines transitions de repliement peuvent être inversées en rétablissant des conditions bénignes (par exemple, repliement après une légère dénaturation).
- Modifications irréversibles: Un traitement sévère (par exemple, des températures élevées ou des agents chimiques) peut conduire à une agrégation ou à un dépliage qui ne peut être inversé.
La stabilité est souvent quantifiée par la température de fusion (Tm), à laquelle la moitié de la population de protéines est dénaturée – un paramètre clé mesuré dans les essais de stabilité (Durowoju et al. 2017).
Méthodes d'évaluation de la stabilité des protéines
De nombreuses techniques orthogonales ont été développées pour étudier la stabilité et les interactions biomoléculaires. Le choix de la méthode appropriée dépend de la question de recherche, du type de protéine et de l’instrumentation disponible.
Calorimétrie différentielle à balayage (DSC)
DSC est un outil essentiel pour les études précises de stabilité des protéines (Durowoju et al. 2017). En mesurant la chaleur nécessaire au dépliage d’un échantillon de protéine à mesure que la température augmente, la DSC détermine :
- Température de dénaturation (Tm) : Indique la stabilité thermique.
- Changements d’enthalpie (ΔH): Révèle les transitions d’énergie de repliement.
- Profils de dépliage: Caractériser les transitions réversibles ou irréversibles.
LA DSC est appréciée pour sa précision dans la détection de transitions subtiles – même pour les protéines à faible concentration – et est particulièrement puissante pour caractériser les variantes, le comportement de formulation thermique et les changements de stabilité induits par les ligands (Qualification d’une méthode DSC 2020).
Autres méthodes d'analyse
Diffusion dynamique de la lumière (DLS): Mesure le rayon hydrodynamique et détecte l’agrégation des protéines, en complément de la stabilité thermique. stabilité thermique thermique (Mirasol et al. 2021).
Spectroscopie UV-Vis: Surveille le déroulement en suivant les changements d’absorbance liés aux chaînes latérales aromatiques ou aux chromophores.
Calorimétrie par titration isotherme (ITC) : Quantifie les interactions de liaison entre les protéines et les ligands ; utile pour détecter les changements de stabilité lors de l’association des ligands (Durowoju et al. 2017).
Spectroscopie du dichroïsme circulaire (CD): Sonde les changements de structure secondaire au cours du repliement ou de la dénaturation (par exemple, passage de l’hélice alpha à la feuille bêta).
Étude des interactions affectant la stabilité
Les protéines interagissent en permanence avec leur environnement moléculaire. L’évaluation de la manière dont ces interactions affectent la stabilité est essentielle pour la recherche et le développement :
- Liaison des ligands: La DSC et l’ITC sont utilisées pour déterminer les affinités de liaison et les effets stabilisants ou déstabilisants des petites molécules, des médicaments et des cofacteurs (Durowoju et al. 2017).
- Agrégation des protéines: La DLS identifie les changements dans la propension à l’agrégation au cours de l’exposition à la chaleur ou au stress (Wang 1999).
- Dépendance à l’égard du pH: En effectuant des analyses DSC à différentes valeurs de pH, les chercheurs peuvent mieux comprendre le rôle des états de protonation dans le repliement.
- Variants génétiques: La comparaison des profils de Tm ou d’agrégation par DSC et DLS permet d’évaluer la stabilité conférée par des mutations ponctuelles ou des changements de séquence (Mirasol et al. 2021).
Comment les méthodes thermiques éclairent les interactions moléculaires
Les techniques thermiques telles que la DSC permettent non seulement d’obtenir le Tm et l’enthalpie, mais lorsqu’elles sont associées à des protocoles de titrage de ligands ou de tampons, elles fournissent des informations approfondies sur les affinités de liaison et la stabilisation structurelle (Durowoju et al. 2017). Par exemple, un ligand qui augmente le Tm d’une protéine suggère une interaction stabilisatrice directe pertinente pour la conception ou la formulation de médicaments.
Perspectives pratiques et paramètres de mesure
L’interprétation des données sur la stabilité des protéines nécessite de prêter attention aux conditions expérimentales et aux résultats typiques :
- Vitesse de chauffage: Influence la détection de la stabilité cinétique par rapport à la stabilité thermodynamique ; les vitesses plus lentes favorisent les mesures d’équilibre.
- Concentration de l’échantillon: Une concentration suffisante garantit un signal fiable sans interférence d’agrégation.
- Composition du tampon: Comparez les effets stabilisants de différents tampons et excipients sur le Tm et l’enthalpie de dépliage (Wang 1999).
- Échantillons de contrôle: Comparez toujours les échantillons à des normes bien définies, telles que les protéines de type sauvage par rapport aux protéines mutantes ou les contrôles de tampon uniquement.
Application
Exemples d'applications
- Comparaison des profils de stabilité des anticorps monoclonaux pour le développement de formulations (Qualification d’un appareil de DSC Method 2020).
- Évaluation de variantes d’enzymes pour la biocatalyse industrielle nécessitant une résistance thermique.
- Le criblage des affinités de liaison protéine-ligand dans la découverte précoce de médicaments et la biologie structurale (Durowoju et al. 2017).
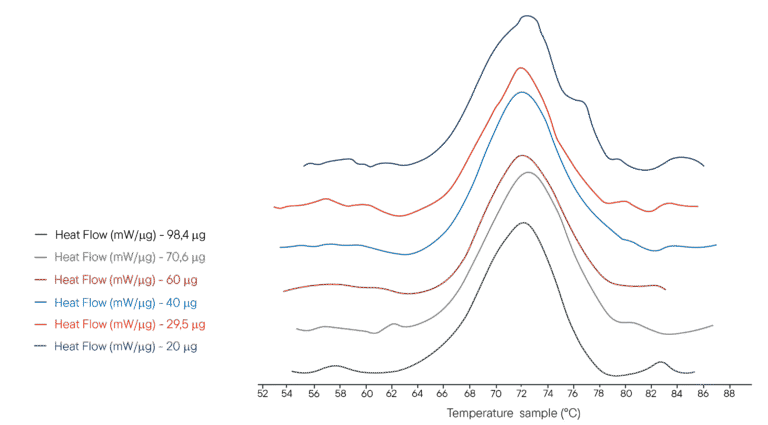
Exemple d’application : Dénaturation thermique du lysozyme
100µL de plusieurs solutions de lysozyme dans un tampon PHB ont été placés dans un creuset de 100µL. Différentes concentrations ont été utilisées, représentant différentes masses de lysozyme analysées respectivement. Le creuset de référence a été rempli avec le même volume de tampon PHB. Le DSC Ultimate a été programmé pour effectuer une rampe de température de 40°C à 95°C à 1°C/min.
L’Ultimate DSC permet de mesurer l’enthalpie et la température de dénaturation du lysozyme en utilisant 5 à 10 échantillons de moins que les instruments actuellement disponibles. Chaque thermogramme a été obtenu en moins de 60 minutes, ce qui permet une analyse rapide. L’Ultimate DSC permet d’économiser de grandes quantités d’échantillons et de travailler plus rapidement.
Choisir la bonne méthode pour votre recherche
Le choix de la méthode analytique optimale dépend de votre protéine spécifique, de votre objectif de recherche et des ressources disponibles :
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
Pour une comparaison détaillée, des revues récentes soulignent comment l’intégration de techniques multiples, y compris des mesures calorimétriques et spectroscopiques précises, conduit à une évaluation robuste de la stabilité des protéines et de leur aptitude à des applications en aval (Mirasol et al. 2021 ; Durowoju et al. 2017).
Conclusion et prochaines étapes
La compréhension et le contrôle de la stabilité des protéines sont essentiels à la réussite de la recherche sur les biomolécules, à la formulation pharmaceutique et au développement de médicaments. L’analyse thermique, en particulier à l’aide de la DSC, fournit des informations solides et quantifiables sur le comportement des protéines dans des conditions pratiques, ce qui vous aide à prendre des décisions fondées sur des données en toute confiance.
Si vous cherchez à faire progresser vos recherches sur la stabilité des protéines, le Linseis UDSC L64 vous offre une technologie de pointe en matière de calorimétrique pour l’analyse biomoléculaire et le développement de formulations. Découvrez les performances de l’UDSC L64 et son large éventail d’applications sur notre page consacrée aux solutions de calorimétrie, ou contactez notre équipe spécialisée pour une consultation personnalisée concernant vos besoins en matière de recherche.
Littérature sélectionnée pour une lecture plus approfondie
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. et Kirkitadze, M. (2017) Differential Scanning Calorimetry-A Method for Assessing the Thermal Stability of Proteins, Journal of Visualized Experiments, (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- Wang, W. (1999) « Instability, stabilization, and formulation of liquid protein pharmaceuticals », International Journal of Pharmaceutics, 185(2), pp. 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. et Kopec, B. (2021) Stability Testing of Protein Therapeutics Using DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- Qualification d’une méthode de calorimétrie différentielle à balayage pour la caractérisation biophysique des anticorps monoclonaux (Open Access). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf