Entalpia
Entalpia – uma variável medida na análise térmica
O que é a entalpia?
A entalpia de reação é a variação de entalpia de uma amostra durante uma reação química. As reacções em que a energia é libertada sob a forma de calor são designadas por exotérmicas. As reacções em que a energia tem de ser fornecida são designadas por endotérmicas.
As entalpias de fusão são um exemplo simples de processos endotérmicos, uma vez que é normalmente necessário aplicar calor a um sistema para quebrar a sua estrutura cristalina sólida e convertê-lo numa fase líquida com moléculas que se podem mover livremente umas em relação às outras. Um exemplo de uma reação exotérmica é um simples processo de combustão em que uma substância reage com o oxigénio, libertando energia.
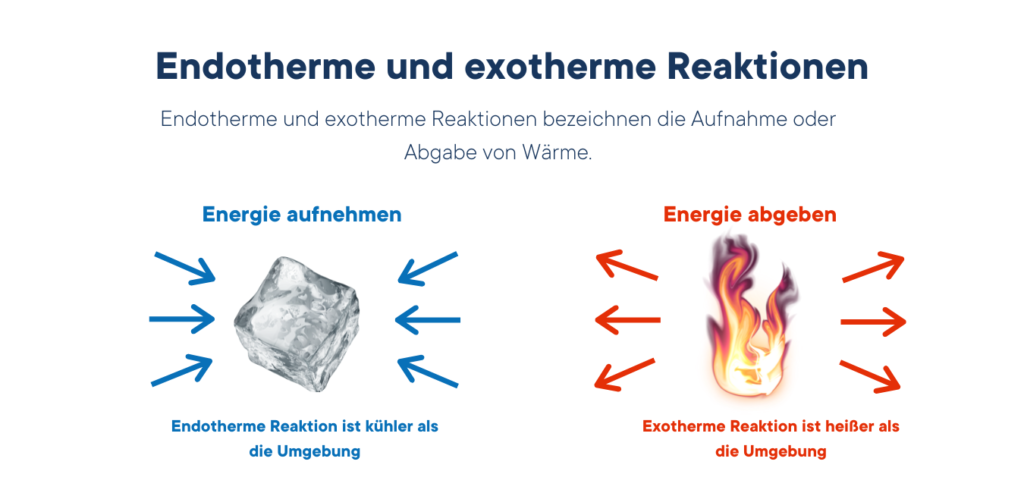
A diferença entre reacções endotérmicas e exotérmicas:
Endotérmico:
- A energia é consumida (o calor é absorvido)
- Energia consumida ou necessária para a reação
- Aumento da entalpia interna
Exemplos de processos endotérmicos são
- Dissolver sais em solventes
- Clivagem de alcanos
- Vaporização de líquidos
- Sólidos em fusão
Exotérmico:
- Liberta energia (liberta calor)
- A reação é espontânea ou desencadeada
- Diminui a entalpia interna
Exemplos de processos exotérmicos:
- A reação de termite
- Neutralização (por exemplo, misturando um ácido e uma base para formar um sal e água)
- A maioria das reacções de polimerização
- Combustão
- Respiração
- Corrosão dos metais (uma reação de oxidação)
- A maioria dos processos de cristalização
