A fórmula química do gesso é CaSO4 ∙ 2H2O(sulfato de cálcio di-hidratado). Há uma variedade de utilizações para o gesso como material de construção.
O gesso é um pó seco que é misturado com água para formar uma pasta, que depois endurece. Mantém-se bastante macio após a secagem e pode ser facilmente trabalhado com ferramentas de metal.
O sulfato de cálcio hemihidratado (CaSO4 ∙ ½H2O) reage com a água para formar sulfato de cálcio dihidratado e volta O sulfato de cálcio dihidratado separa a água quando aquecido e troca-a por sulfato de cálcio hemihidratado.
A clivabilidade do CaSO4 ∙ 2H2Ocristalino é causada por bicamadas de CaSO4(em cada camada os iónicos Ca2 + e SO4 2 estão alternadamente um ao lado do outro) com ligações de hidrogénio relativamente baixas.
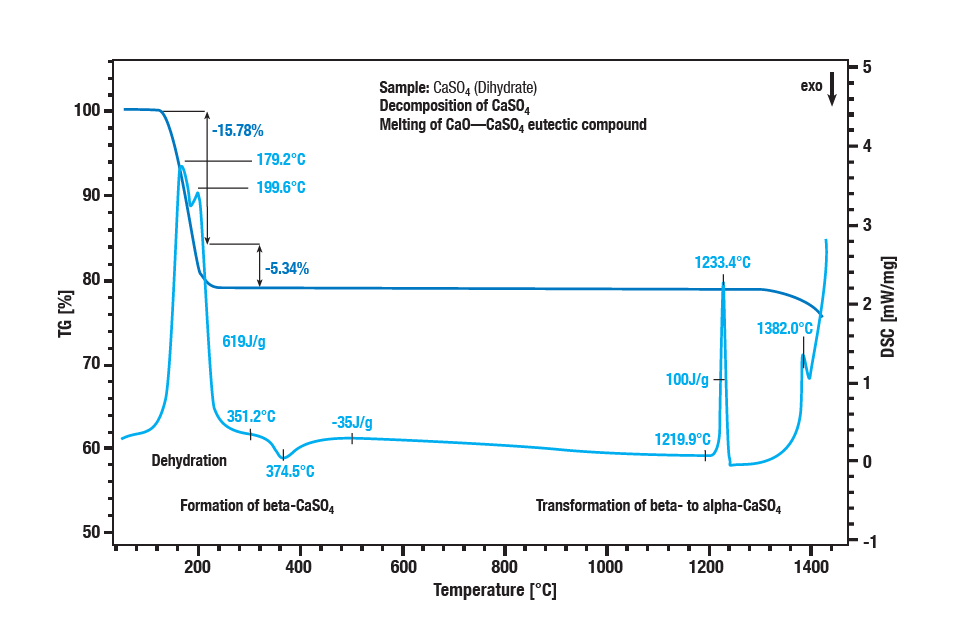
A desidratação em duas etapas do sulfato de cálcio di-hidratado ocorre entre 100 °C e 300 °C. A primeira etapa é a formação de hemihidrato (CaSO4 ∙ 2H2Opara CaSO4 ∙ ½H2O).
A desidratação posterior forma o anidrato (CaSO4 ½ H2Opara CaSO 4). Com um efeito exotérmico a aprox. 340 °C, o anidrato converte-se em sulfato de β-cálcio. O efeito exotérmico na curva a cerca de 1220 °C é a conversão do sulfato de β-cálcio em sulfato de α-cálcio. A decomposição do sulfato reflecte-se numa nova perda de massa a temperaturas superiores a 1250 °C.
O sulfato de cálcio é convertido em óxido de cálcio. A fusão de uma mistura eutéctica de sulfato de cálcio e óxido de cálcio atinge um pico de 1380 °C.

