Tecnologia do hidrogénio e análise térmica
Índice
Energia verde – Ciclo do hidrogénio – Economia do hidrogénio
Uma chave essencial para a energia verde e a mobilidade é a utilização do hidrogénio como combustível, para armazenamento de energia e como ferramenta para os processos de transferência de energia. Por esta razão, foi estabelecido o chamado ciclo do hidrogénio, que mostra a utilização do hidrogénio desde a produção, passando pelo armazenamento e exportação, até à utilização como combustível, e voltando à produção.
Como existem muitos caminhos para cada etapa deste ciclo, foram criados alguns conceitos de investigação para colmatar lacunas e obter acesso a técnicas necessárias e ainda não totalmente desenvolvidas. A Organização de Investigação Fraunhofer desenvolveu e publicou um roteiro do hidrogénio para a Alemanha, no qual são apresentadas todas as áreas e tópicos de investigação.
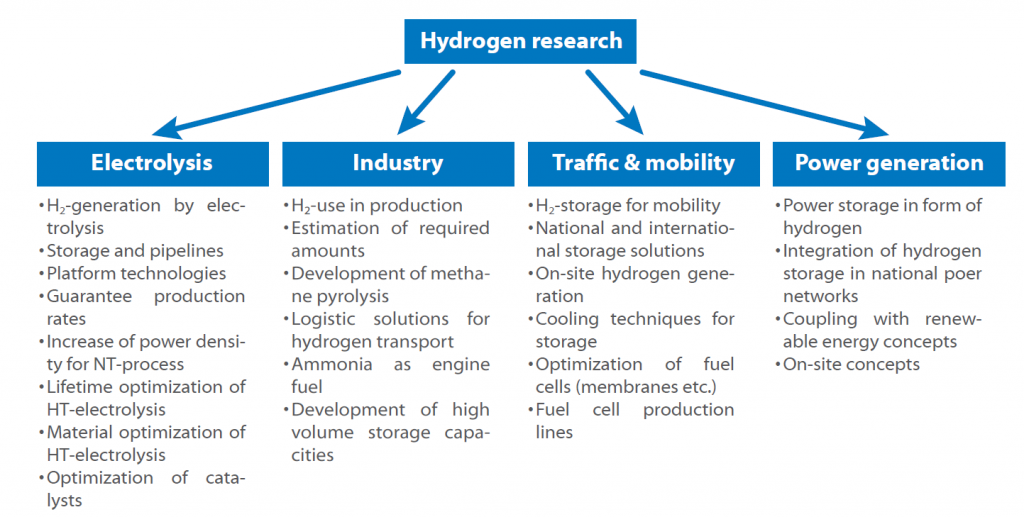
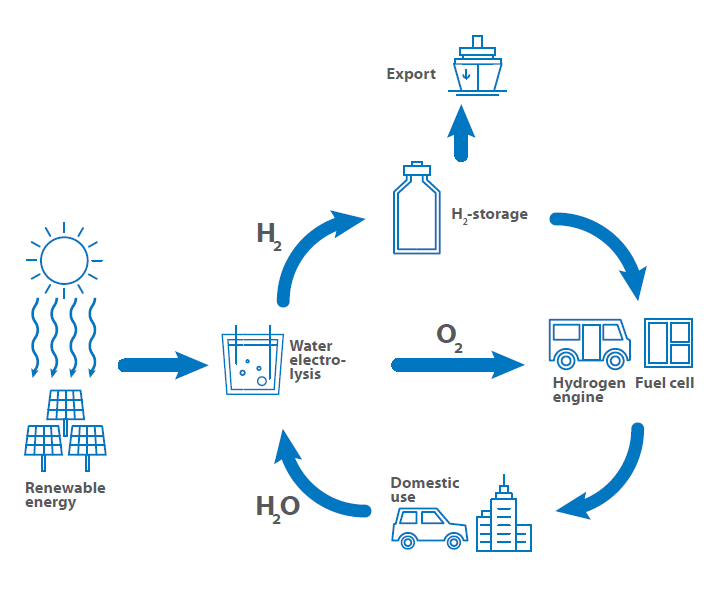
O roteiro mostra a possível utilização do hidrogénio num futuro próximo. A questão fundamental é sempre o armazenamento e a produção, uma vez que todos os sectores são afectados pela questão de saber como armazenar o hidrogénio de forma segura e eficiente.
Outra questão a que é necessário dar resposta é se a produção centralizada ou descentralizada de hidrogénio é mais promissora e se este deve ser utilizado como combustível diretamente ou sob a forma de amoníaco ou substâncias semelhantes.
1. ciclo do hidrogénio – fontes de energia renováveis
O ciclo do hidrogénio começa com a produção de hidrogénio em centrais eléctricas ecológicas. As fontes mais importantes para a produção de energia renovável incluem centrais hidroeléctricas, turbinas eólicas, sistemas fotovoltaicos, centrais geotérmicas e centrais de biomassa, com o objetivo de produzir energia em quantidades suficientes sem emissões de CO2 e sem resíduos nucleares.
Análise térmica e a ciência dos materiais estão presentes em todas as áreas:
- Da investigação sobre materiais compósitos, como os utilizados nas pás das turbinas eólicas
- para a otimização de materiais semicondutores em células fotovoltaicas
- até à otimização da produção direta de hidrogénio a partir de aplicações de biomassa.

Exemplo de aplicação: Comportamento de expansão térmica de materiais leves
Um bom exemplo de como a análise térmica entra em jogo no campo das energias renováveis é o comportamento de expansão térmica de comportamento de expansão de materiais leves, tais como materiais compósitos para pás de turbinas eólicas:
Os materiais compósitos são utilizados na construção leve ou como materiais de construção especiais para muitos fins.
Por exemplo, as pás das turbinas eólicas são feitas de ligas de alumínio leves ou de polímeros leves.
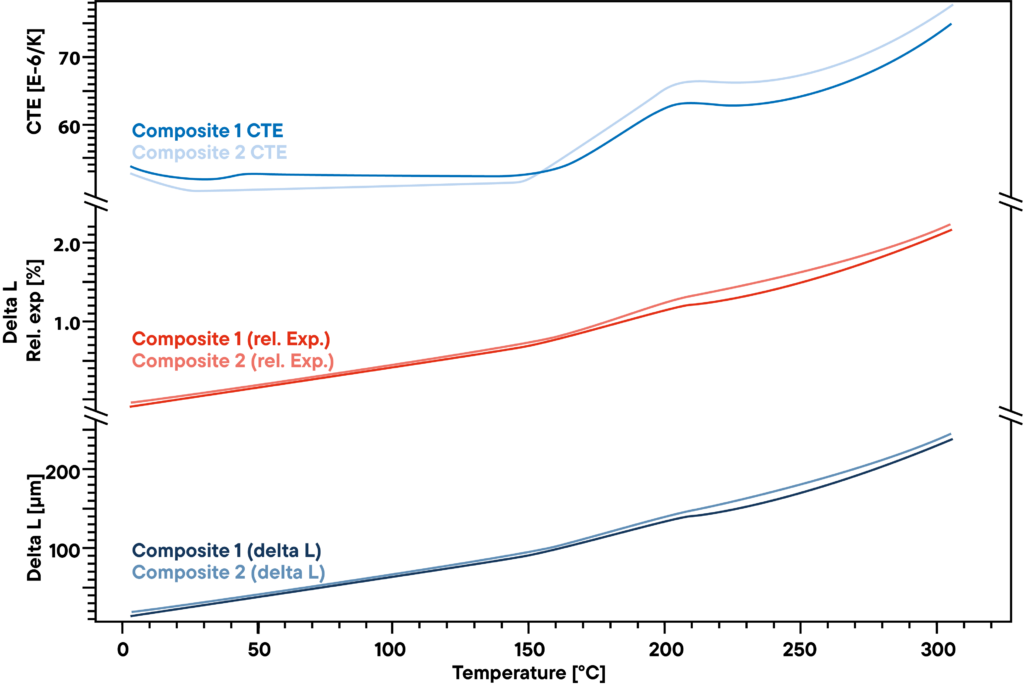
A medição mostra a pequena diferença entre dois compósitos poliméricos utilizados para estruturas rígidas mas leves, como as pás das turbinas eólicas. O delta L absoluto, que foi medido com um dilatómetro de haste de Linseis a uma taxa de aquecimento constante de 5 K/min (curva inferior), não mostra grandes diferenças entre as duas amostras analisadas. A expansão relativa (curvas vermelhas) também é muito semelhante.
No entanto, há uma ligeira diferença que se torna visível quando olhas para o CTE. Antes do ponto de transformação a cerca de 200°C, há um pequeno efeito que só pode ser visto numa das duas amostras e indica outra pequena transformação ou mudança de fase que o outro material não apresenta.
Exemplo de aplicação: DEA – Análise dieléctrica / monitorização da cura
Para uma produção rentável e de alta qualidade de materiais compósitos, é de extrema importância conhecer o tempo exato e o perfil de temperatura necessários para completar a peça específica.
Se estes parâmetros forem selecionados incorretamente, ou a qualidade não pode ser alcançada ou o dinheiro é desperdiçado. Este processo de cura pode ser monitorizado através da DEA – Análise Dieléctrica – se os tempos de espera forem demasiado longos.
A cura da maioria dos polímeros pode ser observada com sensores DEA, que são inseridos no material não curado.
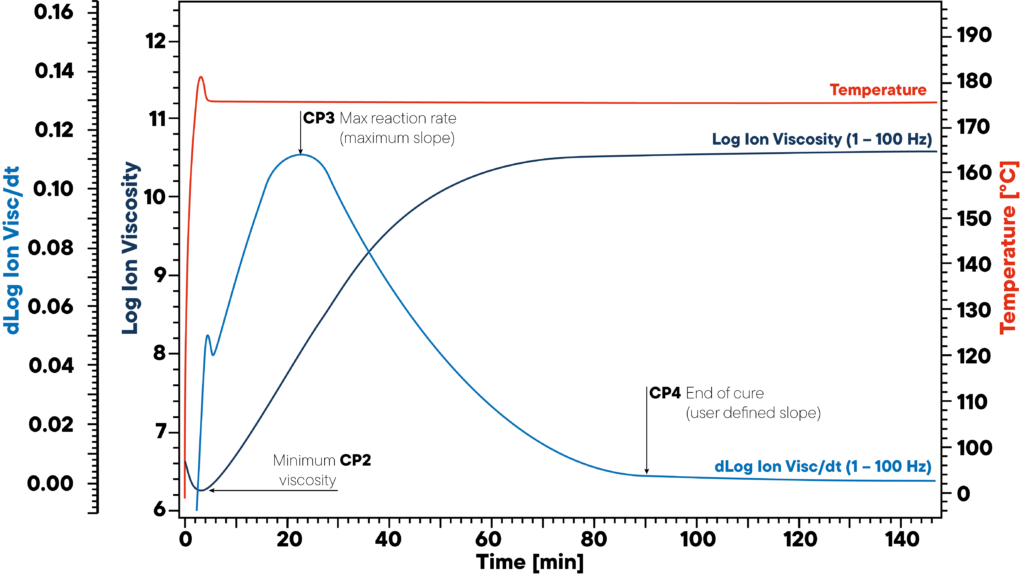
No exemplo, a resina é aquecida isotermicamente a 180 °C e é ligado um sensor DEA. A curva vermelha mostra a temperatura isotérmica da amostra e do sensor. A viscosidade iónica e o declive da viscosidade iónica são monitorizados.
Os três pontos significativos CP2, CP3 e CP4 marcam o início (viscosidade mínima), a velocidade máxima de reação (inclinação máxima) e o fim da cura. Esta informação é crucial para a cura correta do polímero, uma vez que os materiais não curados podem conduzir a graves problemas de qualidade.
Exemplo de aplicação: Qualidade e comportamento de matérias-primas, por exemplo, biomassa
Outro ponto importante para a produção de hidrogénio é a qualidade e o comportamento das matérias-primas, por exemplo, a biomassa utilizada para gerar eletricidade e hidrogénio.
 A questão é saber qual a quantidade de hidrogénio que pode ser obtida a partir de diferentes matérias-primas durante a gaseificação, qual a quantidade de energia necessária para tal e qual o resultado global. Isto pode ser monitorizado por termogravimetria de pressão e termogravimetria e calorimetria combinadas (STA), como mostra o seguinte exemplo de aplicação.
A questão é saber qual a quantidade de hidrogénio que pode ser obtida a partir de diferentes matérias-primas durante a gaseificação, qual a quantidade de energia necessária para tal e qual o resultado global. Isto pode ser monitorizado por termogravimetria de pressão e termogravimetria e calorimetria combinadas (STA), como mostra o seguinte exemplo de aplicação.
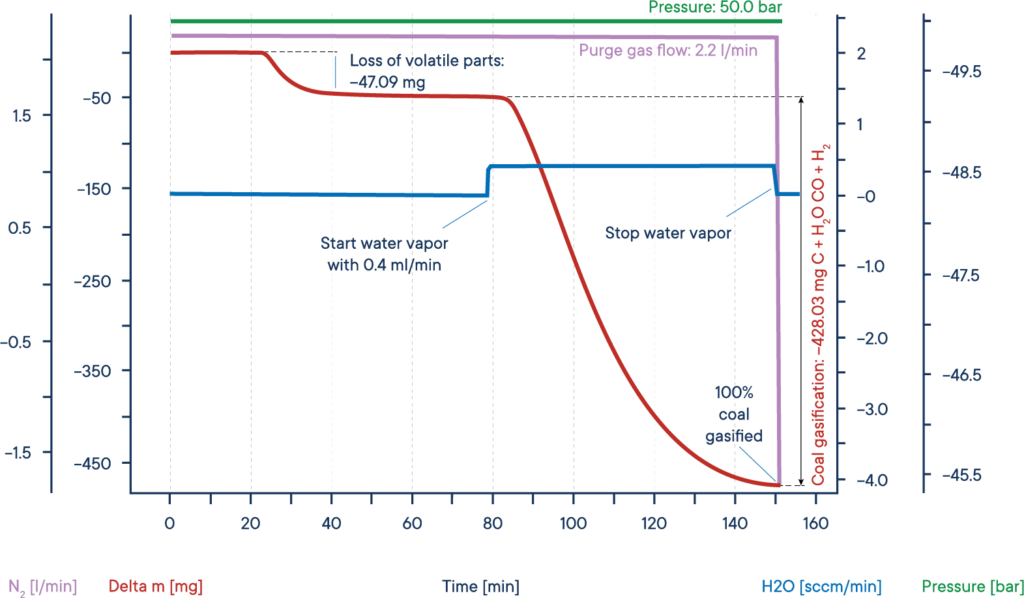
Uma aplicação típica das medições de TGA a alta pressão é a investigação da chamada gaseificação ou hidrogasificação do carvão. Este processo, no qual o carbono é aquecido numa atmosfera de vapor de água, é utilizado em processos catalíticos, por exemplo, para remover o monóxido de carbono dos gases de escape e, especialmente, para extrair compostos orgânicos valiosos de recursos como o carvão vegetal ou a biomassa.
O exemplo dado mostra um ensaio típico de gaseificação de biomassa seca. A amostra de biomassa foi aquecida até um patamar isotérmico sob uma atmosfera de azoto a uma pressão de 50 bar ( TGA de alta pressão – termobalanço ).
O sinal de massa mostra a perda de voláteis entre 20 e 40 minutos. Após a adição de vapor de água, a biomassa foi gaseificada e quase completamente consumida após 150 min, resultando em H2, CO, CH3OH e outros gases reactivos úteis, como mostra a curva de perda de massa a vermelho.
Todo o processo pode ser descrito da seguinte forma: O carbono reage com o vapor de água para formar uma mistura de monóxido de carbono e hidrogénio. O monóxido de carbono resultante pode reagir com uma segunda molécula de água para formar dióxido de carbono e mais hidrogénio e, finalmente, o hidrogénio resultante pode formar metano e outros hidrocarbonetos a partir do monóxido de carbono.
Exemplo de aplicação: Investigação do comportamento de combustão e do teor de cinzas de materiais compósitos
Por último, mas não menos importante, os materiais compósitos devem ser reciclados ou utilizados para fins energéticos após o fim da vida útil do produto. Para este efeito, pode ser interessante investigar o comportamento de combustão e o teor de cinzas.
Os materiais carbonados, as substâncias orgânicas e os polímeros ardem geralmente quando aquecidos. O estudo da decomposição térmica destes materiais é, portanto, algo especializado. Na maior parte dos casos, é efectuado em atmosferas inertes em vez de ar, a fim de observar os efeitos da decomposição e da pirólise, seguidos de uma troca de gás para o oxigénio ou para o ar, o que leva a uma queima do carbono contido.
Se este processo for realizado num analisador térmico combinado (STA), é possível medir o teor de carbono, o teor inorgânico e o calor libertado.
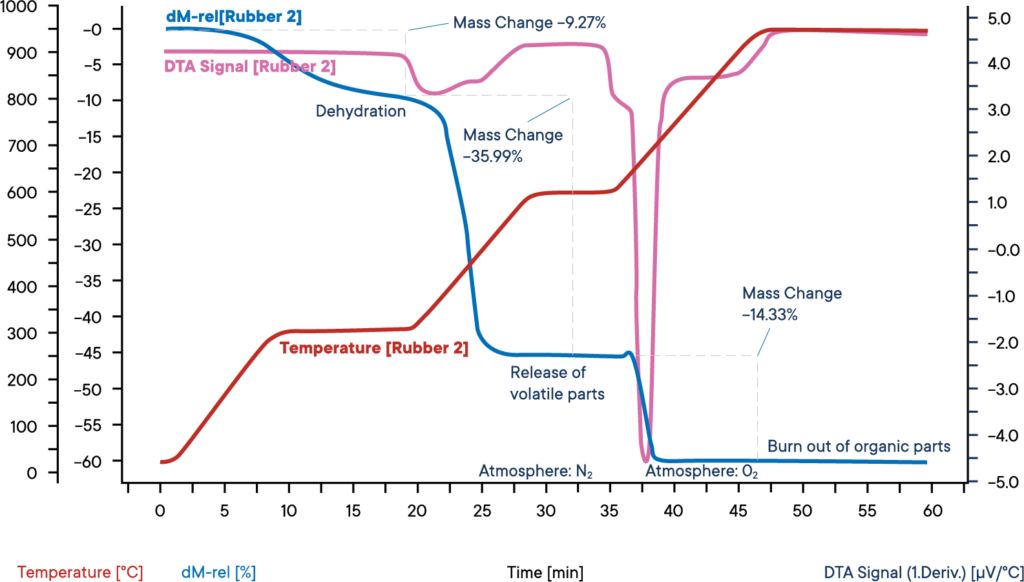
Esta medição de uma amostra de borracha industrial foi efectuada com uma termobalança simultânea STA L81 com arranque em atmosfera de azoto.
A amostra foi aquecida em três etapas, cada uma a 30 K/min. A curva azul mostra a perda de peso relativa. A desidratação da amostra ocorre na primeira perda de peso. O teor de água era de 9,3 %. O sinal DTA correspondente (curva roxa) não mostrou qualquer efeito durante a evaporação da água.
Na segunda fase da reação, os componentes voláteis são libertados por pirólise numa atmosfera de N2. A proporção destes componentes é de 36,0 %. A sua libertação pode ser reconhecida por um pico de reação exotérmica na curva DTA.
Na terceira fase da reação, a atmosfera é alterada para O2, o que leva à combustão do carbono restante. A perda de peso é de 14,3 %. Os restantes 40,4 % são componentes inorgânicos, como cinzas, escórias ou cargas.
2. conversão da energia eléctrica em energia química (eletrólise, combustíveis sintéticos)
A eletrólise da água é a divisão química da água em oxigénio e hidrogénio através da aplicação de uma tensão externa. Como este processo de produção de hidrogénio requer muita energia, são também utilizados processos que produzem hidrogénio utilizando catalisadores ou cadeias de reação, como a gaseificação do carvão.
No entanto, o objetivo é conseguir uma eletrólise direta com elevado rendimento e eficiência. Para melhorar a eficiência da eletrólise, é necessário otimizar os materiais do cátodo e do ânodo, bem como os catalisadores e os materiais de superfície.
Como a energia eléctrica é difícil de armazenar, as grandes centrais eléctricas actuais, como as centrais a carvão e as centrais nucleares, produzem uma quantidade contínua de energia para cobrir a carga de base, enquanto as centrais mais variáveis, como as centrais a gás, são utilizadas para compensar as flutuações.
Dado que a produção de eletricidade a partir de fontes de energia renováveis está sujeita a flutuações (por exemplo, à noite, durante a seca ou quando não há vento), a energia produzida tem de ser armazenada a fim de cobrir a necessidade de uma procura de energia contínua e flutuante com a produção intermitente de fontes de energia renováveis.
Além disso, algumas aplicações, como a mobilidade (automóveis, camiões, aviões de longo alcance), requerem grandes quantidades de energia. O armazenamento de energia eléctrica em acumuladores não é prático, uma vez que os acumuladores com as dimensões necessárias são caros e não estão prontos a ser utilizados. Para estas aplicações, é mais vantajoso converter a energia eléctrica em energia química sob a forma de combustíveis sintéticos ou de hidrogénio. Uma vez que os combustíveis sintéticos também são produzidos com hidrogénio, o passo mais importante é a produção de hidrogénio a partir da água por eletrólise.
Exemplo de aplicação: Catalisadores – Expansão térmica de fios de platina
 A análise térmica pode ajudar neste caso, caracterizando os materiais utilizados em termos de estabilidade química, condutividade térmica e capacidade de sorção, mas também determinando a expansão térmica, de modo a melhorar a vida útil e a qualidade.
A análise térmica pode ajudar neste caso, caracterizando os materiais utilizados em termos de estabilidade química, condutividade térmica e capacidade de sorção, mas também determinando a expansão térmica, de modo a melhorar a vida útil e a qualidade.
A platina é utilizada como catalisador, como material puro ou em muitas ligas. Dado que a utilização como liga é a mais comum devido a várias vantagens que uma liga tem, o comportamento físico e químico muda ligeiramente. O exemplo mostra a diferença na expansão térmica entre a platina e a platina com 3 % de ródio.
No exemplo, a platina e uma liga de platina foram medidas num dilatómetro de haste de pressão Linseis com uma taxa de aquecimento linear de 5 K/min. As duas curvas inferiores mostram a expansão térmica absoluta, as curvas superiores mostram a expansão relativa de uma amostra de platina comparada com uma liga de platina-ródio.
Mesmo com apenas uma ligeira diferença na composição química, o comportamento de expansão mostra um desvio de alguns μm na gama até 1000 °C. Quando utilizado numa estrutura complexa, como um reator, os valores exactos de expansão devem ser tidos em conta para evitar danos na unidade de eletrólise devido a diferentes coeficientes de expansão.

Exemplo de aplicação: Gestão térmica – condutividade térmica da grafite
Para além da expansão térmica, que pode causar problemas numa estrutura complexa, as propriedades termofísicas, como a condutividade térmica e a resistência específica, são também muito importantes.
 A chave é a gestão térmica correta. Se não houver grandes diferenças de temperatura dentro do reator, não haverá problemas de expansão térmica. Por esta razão, também é bom conhecer as propriedades de transporte térmico de todos os materiais utilizados.
A chave é a gestão térmica correta. Se não houver grandes diferenças de temperatura dentro do reator, não haverá problemas de expansão térmica. Por esta razão, também é bom conhecer as propriedades de transporte térmico de todos os materiais utilizados.
Resumindo: A otimização das propriedades termofísicas ajuda a poupar custos e a melhorar a qualidade. Os catalisadores nanoestruturados, por exemplo, têm uma maior área de superfície ativa e requerem menos matéria-prima.
A grafite é um tipo de carbono que se apresenta como um sólido cinzento escuro. Tem uma resistência química extraordinariamente elevada e é utilizada de muitas formas diferentes, por exemplo, como material catódico, material de construção, componente de sensores e muito mais. Quando aquecido, reage com o oxigénio para formar monóxido de carbono ou dióxido de carbono, mas pode atingir temperaturas muito elevadas quando aquecido num ambiente inerte e sem oxigénio, pelo que é utilizado como material de forno ou mesmo como aquecedor em fornos de temperatura ultra-alta.
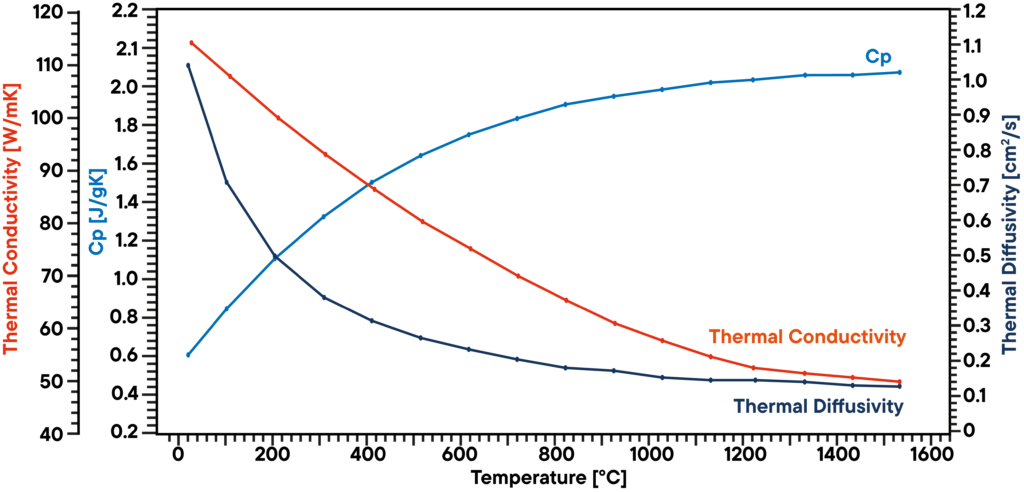
Neste exemplo, uma amostra de grafite foi analisada em vácuo utilizando um LFA 1000 (Laserflash Analyzer). A difusividade térmica foi medida diretamente em várias etapas de temperatura entre RT e 1100°C. A capacidade térmica específica foi determinada com um padrão de grafite conhecido numa segunda posição da amostra como referência na mesma medição.
O produto da difusividade térmica, do calor específico e da densidade dá a condutividade térmica correspondente. O resultado mostra uma condutividade térmica linearmente decrescente, o que é típico, e uma difusividade térmica que mostra um patamar acima dos 500°C. O valor Cp aumenta ligeiramente com a temperatura.
Exemplo de aplicação: Combustível sintético – reacções dependentes da pressão devido à alta pressão STA
Para algumas aplicações, como os aviões, pode ser vantajoso ligar a energia eléctrica numa forma mais estável do que o hidrogénio, que é o que os combustíveis sintéticos são.
Os combustíveis sintéticos têm a grande vantagem de poderem ser utilizados sem alterações nas infra-estruturas e construções existentes. A ideia é utilizar o hidrogénio verde e produzir hidrocarbonetos sintéticos a partir dele. O CO2 é capturado da atmosfera durante o processo de produção, mas o CO2 é novamente libertado quando o combustível sintético é utilizado (queimado).
O processo de produção de combustíveis sintéticos (processo Fischer-Tropsch) pode ser optimizado com sistemas TG e TG/DSC de alta pressão, como o LINSEIS High Pressure -STA.
A série STA HP da Linseis permite efetuar medições sob pressão controlada e elevada. Para algumas reacções, como a decomposição, adsorção e dessorção, o comportamento de amostras e materiais é altamente dependente das condições atmosféricas, uma vez que existe uma dependência da pressão em muitas reacções.
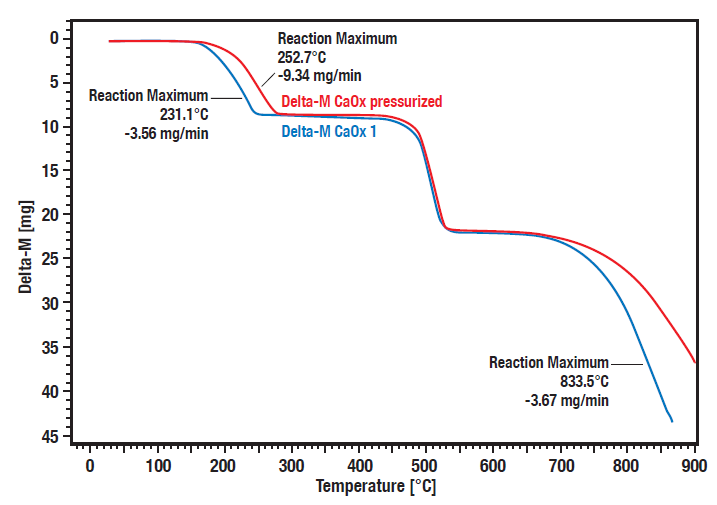
Estas curvas mostram a medição comparativa da decomposição do hidrato de oxalato de cálcio sob pressão (20 bar, curva vermelha) vs. condições atmosféricas (curva azul). Reconhece-se uma clara dependência da pressão das etapas de decomposição 1 (perda de água) e 3 (perda de dióxido de carbono).
As etapas de decomposição 1 e 3 são deslocadas para temperaturas mais elevadas a uma pressão maior. A segunda etapa é a conversão irreversível do oxalato orgânico em carbonato inorgânico com a libertação de monóxido de carbono. Como não é reversível, não depende da pressão.
3. armazenamento de hidrogénio
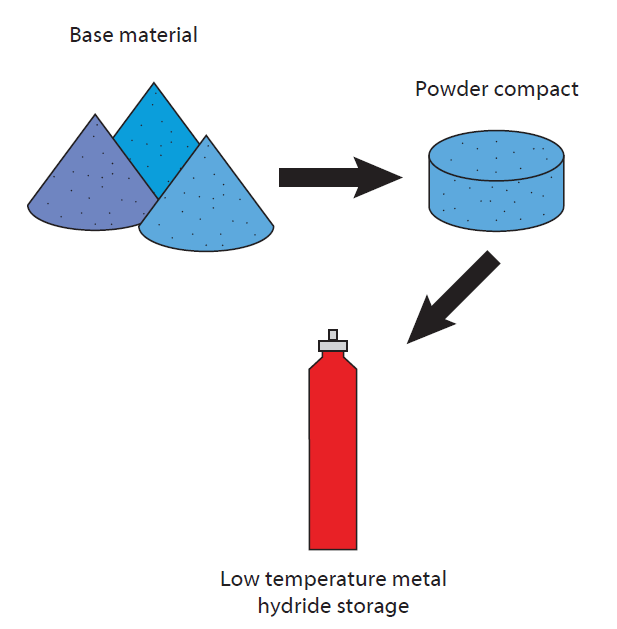
Como o hidrogénio é um gás muito volátil, o seu armazenamento e transporte constituem um grande desafio. Pode ser armazenado em cilindros através da compressão do gás H2, mas devido à elevada pressão necessária (existem cilindros com uma pressão máxima de até 700 bar) e às questões tecnológicas e de segurança associadas (o hidrogénio difunde-se através de qualquer material ao longo do tempo), são preferidas outras tecnologias.
Por exemplo, o hidrogénio pode ser armazenado por sorção em vários materiais onde se encontra mais ou menos fixado quimicamente (estruturas metal-orgânicas (MOF), zeólitos, líquidos iónicos, etc.). No entanto, o armazenamento como hidreto metálico é o mais promissor.
Neste caso, o hidrogénio é quimicamente ligado a uma superfície metálica, formando o hidreto estável. Este processo pode ser optimizado aumentando a área de superfície através da utilização de materiais porosos, como zeólitos e estruturas sintéticas com nanoporos. Em muitos materiais, o hidrogénio pode então ser libertado através de alterações de temperatura controladas ou de alterações de pressão facilmente aplicadas. O risco de difusão descontrolada deixa de existir.
Exemplo de aplicação: Sorção STA a alta pressão
Análises térmicas, nomeadamente análises gravimétricas podem ajudar a determinar as condições exactas de sorção, as taxas de libertação e de armazenamento, a fim de otimizar os ciclos de carga e de libertação.
A medição da sorção, que é efectuada através de métodos volumétricos, não fornece normalmente qualquer informação sobre o fluxo de calor e a entalpia. Se o calor de sorção for de interesse, é necessária uma segunda experiência.
O analisador de sorção gravimétrica ( TG-DSC de alta pressão ), que mede tanto a alteração de peso (termogravimetria TGA) como o sinal de calorimetria diferencial de varrimento (DSC), oferece uma alternativa muito mais rápida.
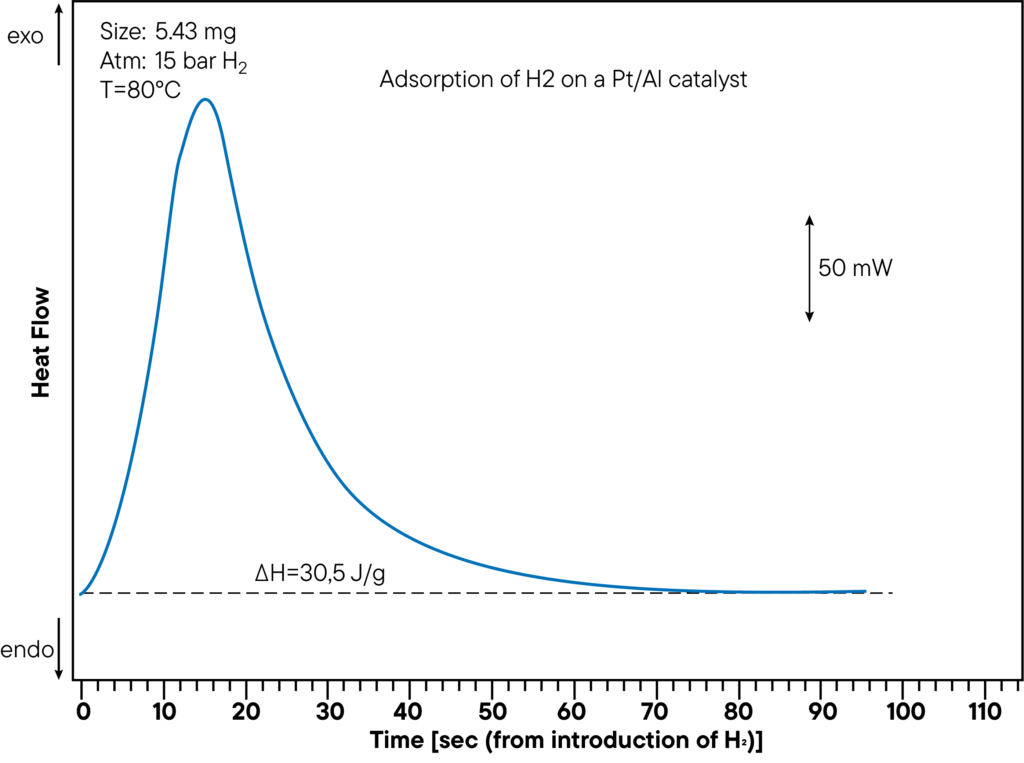
Tanto a capacidade de sorção como o calor de sorção podem ser medidos num ensaio. A figura mostra a secção de medição DSC da adsorção de hidrogénio num catalisador Pt/Al a uma pressão de 15 bar e a uma temperatura de 80°C. O calor gerado é de 30,5 J/g. O calor de sorção foi determinado diretamente durante a experiência de sorção e mostra um pico claro. Na curva acima, o tempo desde a injeção de hidrogénio até à reação de sorção foi monitorizado para mostrar a rapidez com que a amostra interage com a atmosfera.
4. Dispositivos e processos que utilizem o hidrogénio como combustível
Uma vez que o hidrogénio tenha sido produzido e armazenado e esteja disponível para utilização (móvel), a sua elevada densidade energética permite uma grande variedade de aplicações.
As utilizações mais comuns são como agente redutor, combustível, gás de transporte e para sintetizar moléculas como os hidratos de carbono, o amoníaco e muitas outras. Uma aplicação frequentemente utilizada é a sinterização de metais.
As peças de trabalho metálicas ou contendo óxidos metálicos são frequentemente produzidas através da compactação de pós nos chamados corpos verdes. Estes corpos verdes são posteriormente solidificados por aquecimento a uma temperatura abaixo do ponto de fusão, um processo conhecido como sinterização. Durante a sinterização, as dimensões são reduzidas. Consequentemente, o processo de sinterização pode ser analisado através da medição das dimensões. Isto é normalmente feito num dilatómetro (ver exemplo de aplicação).
A fim de evitar a oxidação e também para reduzir o teor de óxidos no produto final, a sinterização pode ter lugar numa atmosfera contendo hidrogénio ou mesmo numa atmosfera de hidrogénio puro.
Graças à sua experiência na tecnologia de segurança do hidrogénio, a LINSEIS está em condições de fornecer dilatómetros para utilização em atmosferas de hidrogénio puro. O dilatómetro pode ser utilizado para medições de sinterização ou expansão de hidrogénio em atmosferas redutoras. A desgaseificação é acoplada a uma unidade de combustão de segurança e o sistema está ligado a um detetor de hidrogénio que pode desligar o sistema e purgá-lo com gás inerte em caso de libertação descontrolada de hidrogénio.
Exemplo de aplicação: Sinterização H2 de pós metálicos
O exemplo mostra a sinterização por hidrogénio de corpos verdes de pó metálico que são utilizados como catalisadores.
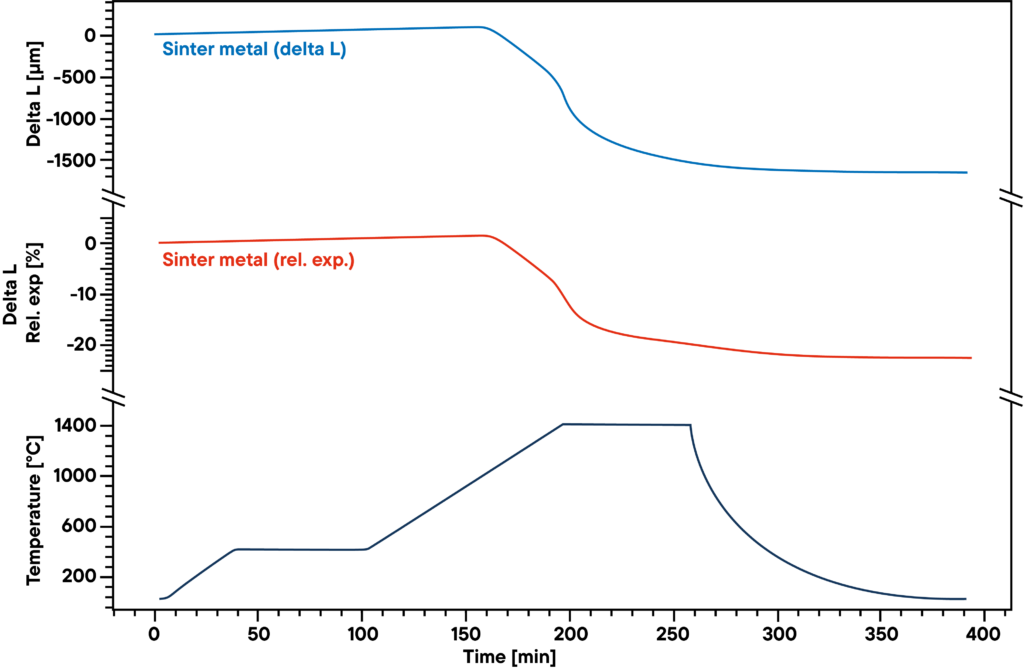
A medição mostra a curva de sinterização do pó metálico sinterizado prensado, que foi aquecido numa atmosfera de hidrogénio absoluto de acordo com o perfil de sinterização (curva inferior).
O hidrogénio reduz o oxigénio contido na amostra durante o processo de sinterização e resulta numa maior densidade e num menor teor de óxido metálico. Por conseguinte, tanto a atmosfera de gás como o perfil de sinterização têm uma influência significativa nos resultados.
A curva azul mostra a expansão e a contração relativas, a curva vermelha mostra os valores absolutos. A principal etapa de sinterização pode ser observada na segunda fase de aquecimento entre 500°C e 1400°C.
5. tecnologia das pilhas de combustível
No entanto, as aplicações mais interessantes e mais frequentemente mencionadas para o hidrogénio são as células de combustível, que podem ser utilizadas em muitas situações diferentes, desde o fornecimento de eletricidade e calor a edifícios até à propulsão de automóveis com maior autonomia. As células de combustível são a peça-chave para converter a energia armazenada do hidrogénio em eletricidade.
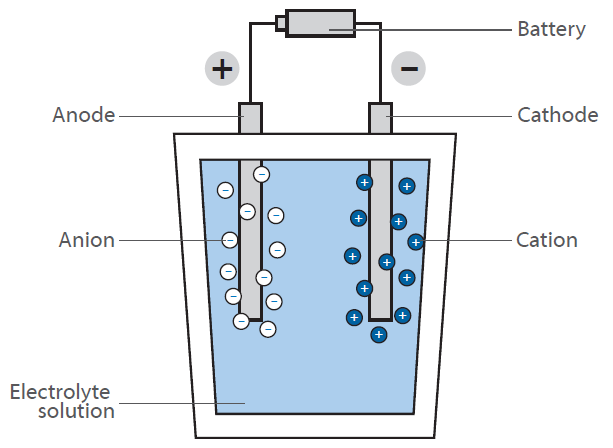
Numa célula de combustível, o hidrogénio reage com o ar para formar água. Esta reação não é utilizada diretamente por combustão com libertação de calor, mas numa pilha de combustível para gerar energia eléctrica: O diagrama mostra uma representação esquemática de uma pilha de combustível a hidrogénio.
A sua função é gerar energia eléctrica “a pedido” através da reação do hidrogénio e do oxigénio. Ao contrário da reação clássica, direta, em que se forma água com uma grande libertação de energia sob a forma de calor (imagina uma mistura de gás hidrogénio-oxigénio que se inflama), uma célula de combustível tem duas câmaras onde se encontram os dois compostos.
No centro destas câmaras encontra-se uma membrana que permite a difusão do hidrogénio, mas não de outras moléculas. Na superfície da membrana, do lado da câmara de oxigénio, ocorre a reação entre o hidrogénio e o oxigénio, produzindo água que é levada para fora da célula. Isto leva a uma diminuição da concentração de hidrogénio na membrana e faz com que mais moléculas de hidrogénio migrem para a membrana.
A difusão do hidrogénio na câmara que contém oxigénio gera uma tensão eléctrica na membrana. Esta é a energia que é agora libertada em vez de calor e pode ser utilizada para fazer funcionar um motor.
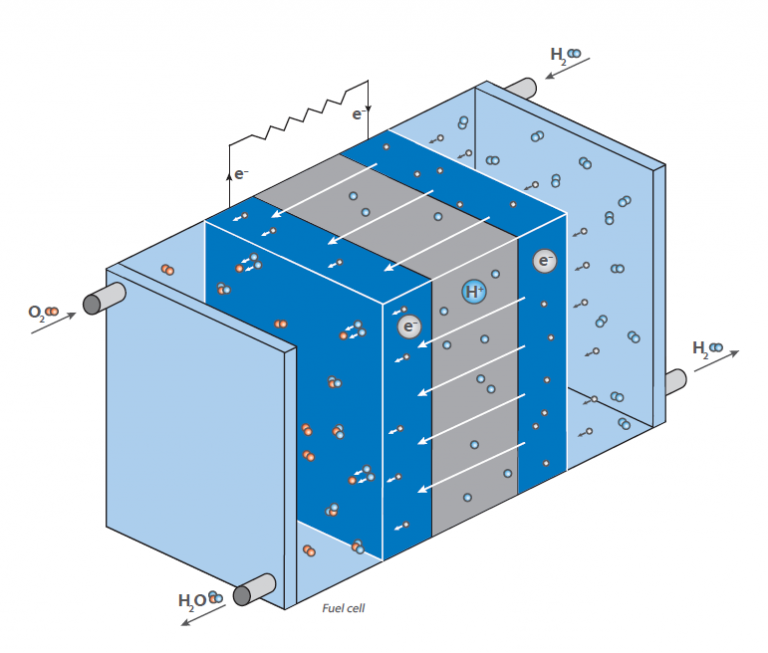
Como a concentração de hidrogénio na câmara de hidrogénio pode ser regulada, a taxa de difusão na membrana pode ser facilmente controlada, tal como num motor a gasolina. O hidrogénio pode, portanto, ser considerado como um “combustível”. A membrana é coberta por um material de elétrodo constituído por metais preciosos. Estes metais actuam como catalisadores e influenciam as condições de funcionamento da pilha de combustível (temperatura, tensão, etc.).
Uma vez que as células de combustível alimentadas a hidrogénio podem funcionar a temperaturas elevadas, até 1000°C, e que a solda utilizada para as montar deve ser estável do ponto de vista térmico, químico e mecânico, é aqui que a análise térmica entra novamente em jogo. As condições de funcionamento das pilhas de combustível dependem dos materiais utilizados, que podem atuar como catalisadores.
Por exemplo, todas as técnicas utilizadas para caraterizar os catalisadores têm aplicações na tecnologia das células de hidrogénio/combustível. Consequentemente, são necessários muitos conhecimentos em ciência dos materiais e muitas técnicas analíticas ajudam a analisar os materiais. Neste caso, centrar-nos-emos nas técnicas de análise térmica.
Algumas aplicações de armazenamento de hidrogénio funcionam a alta pressão, por vezes superior a 100 bar, pelo que os analisadores pressurizados são úteis. Além disso, todas as técnicas de análise exigem precauções devido à elevada reatividade do hidrogénio com o oxigénio/ar. Por conseguinte, todos os analisadores devem estar equipados com caraterísticas de segurança para evitar o risco de explosões.
Exemplo de aplicação: Libertação de hidrogénio do armazenamento de superfície
O seguinte exemplo de aplicação mostra onde os dispositivos de análise térmica e de ciência dos materiais são utilizados no domínio das células de combustível.
O armazenamento de hidrogénio pode assumir a forma de adsorção superficial, adsorção nos poros ou absorção química. Para a maioria dos metais, a adsorção superficial é a via mais promissora, uma vez que é fácil de conseguir e a libertação de hidrogénio pode ser muito bem controlada. Por conseguinte, estão a ser investigados muitos metais com uma área superficial específica elevada.
O hidreto de titânio é uma fonte de hidrogénio frequentemente utilizada para a libertação controlada de hidrogénio em várias reacções. Por um lado, pode ser utilizado como catalisador em química líquida in situ como fonte de hidrogénio e, por outro lado, pode ser utilizado em baterias ou células de combustível para libertação controlada de hidrogénio, por exemplo.
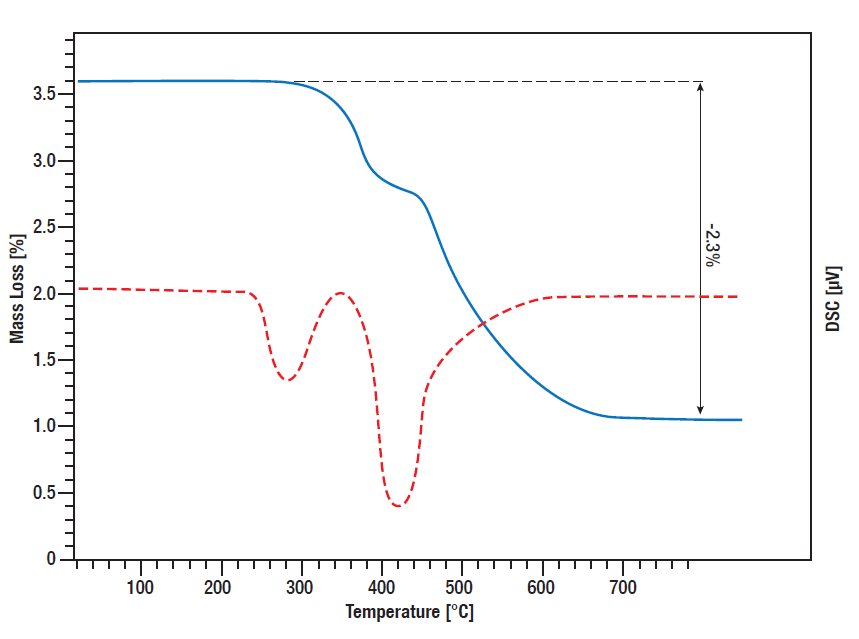
Para ter uma ideia da quantidade de hidrogénio libertada a que temperatura, é importante conhecer o comportamento de decomposição dependente da temperatura e a quantidade de calor libertada, que pode ser monitorizada por análise térmica simultânea (STA).
Nesta medição STA, foi monitorizada a libertação de hidrogénio pelo hidreto de titânio. Os sinais TG e DSC foram medidos desde a temperatura ambiente até 800°C enquanto a amostra era aquecida linearmente em atmosfera de árgon a 10 K/min. Entre 300°C e 600°C, há uma perda de massa em duas fases, totalizando 2,3%, o que significa que toda a quantidade de hidrogénio ligado é libertada neste processo. A curva DSC mostra os picos de dessorção correspondentes (curva vermelha).
Segurança nas medições de hidrogénio
O hidrogénio tem uma grande afinidade com os agentes oxidantes e as superfícies metálicas, bem como com o oxigénio. A formação de água a partir dos elementos (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) é uma reação exotérmica, razão pela qual o hidrogénio é considerado uma poderosa reserva de energia.
As misturas de hidrogénio-ar com um teor de hidrogénio superior a cerca de 4 % são potencialmente explosivas. A energia de ativação (sem catalisador) é elevada, mas na presença de uma chama, faísca ou temperatura elevada, essas misturas podem arder ou explodir. Por conseguinte, são necessárias algumas precauções de segurança para qualquer análise térmica com concentrações de hidrogénio superiores a 4% no ar.
Todos os analisadores térmicos LINSEIS para aplicações com hidrogénio podem ser equipados com as seguintes caraterísticas de segurança:

- Detectores de hidrogénio: detectam eventuais fugas nas condutas de gás. Estes detectores são colocados perto do aparelho e detectam qualquer fuga ou libertação acidental de hidrogénio.
- Purga com gás inerte: Se for detectada uma fuga e o abastecimento de hidrogénio for interrompido, o hidrogénio residual no analisador é purgado com gás inerte.
- Válvulas de segurança:
Assim que é detectada uma fuga de hidrogénio, as válvulas de segurança são activadas e interrompem o fornecimento de hidrogénio ao analisador térmico.
- Unidade de resíduos para desgaseificação:
Todos os sistemas de hidrogénio da Linseis estão equipados com uma unidade de queima na ligação de desgaseificação. As emissões (gás de amostra, gás de purga e produtos de decomposição) passam através da chama em constante combustão para garantir que não são libertados gases inflamáveis para o ambiente e que podem atingir uma concentração crítica no laboratório. A unidade de chama é aquecida eletricamente e possui um mecanismo de segurança que evita que a chama se volte a incendiar nas linhas de gás.
