Índice
Qual é a diferença entre reacções endotérmicas e exotérmicas?
A principal diferença entre as reacções exotérmicas e endotérmicas reside na troca de calor com o ambiente:
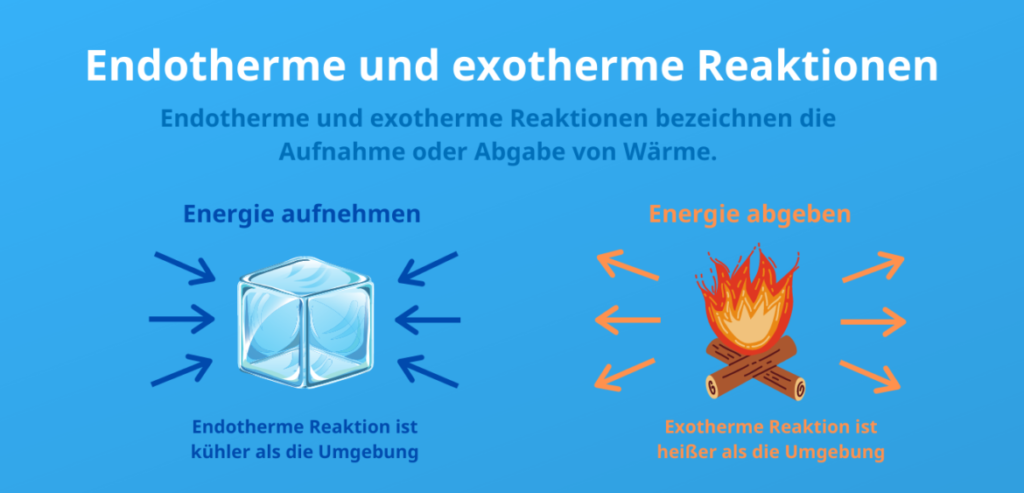
- As reacções endotérmicas absorvem energia sob a forma de calor do meio envolvente, o que faz com que este se torne mais frio. Isto significa que os produtos têm mais energia do que os reagentes e que a reação requer calor, o que leva a uma variação positiva da entalpia (ΔH).
- As reacções exotérmicas libertam energia para o meio envolvente sob a forma de calor, o que faz com que o meio envolvente fique mais quente. Neste caso, os produtos têm menos energia do que os reagentes e a reação liberta calor, o que leva a uma variação negativa da entalpia (ΔH).
Como é que identificas uma reação exotérmica ou endotérmica?
Existem dois métodos para reconhecer as reacções exotérmicas:
- Mudança de temperatura;
- Numa reação exotérmica, a energia é libertada, o que provoca o aumento da temperatura da mistura reacional. Por outro lado
, numa reação endotérmica , a energia é absorvida, o que leva a uma diminuição da temperatura. Podes observar as alterações de temperatura colocando um termómetro na mistura reacional
- Numa reação exotérmica, a energia é libertada, o que provoca o aumento da temperatura da mistura reacional. Por outro lado
- Alteração de entalpia:
- A variação de entalpia (ΔH) é a diferença entre a energia dos produtos e a energia dos reagentes. Se ΔH for negativo, trata-se de uma reação química exotérmica, porque é libertada mais energia quando os produtos são formados do que a energia utilizada para decompor os reagentes. Se ΔH for positivo, trata-se de uma reação química endotérmica, porque a energia libertada na formação dos produtos é menor do que a energia utilizada na decomposição dos reagentes.
As reacções exotérmicas e endotérmicas têm efeitos diferentes no ambiente:
As reacções exotérmicas libertam calor para o ambiente, o que pode ter efeitos ambientais positivos e negativos. Por exemplo, estão envolvidas em processos como a respiração, a combustão e a produção de energia. No entanto, as reacções exotérmicas podem também contribuir para problemas ambientais como a poluição do ar e da água.
Outros exemplos de reacções exotérmicas:
- Queima lenha ou carvão:
- Quando a madeira ou o carvão são queimados, liberta calor, que é exotérmico. Estas reacções são utilizadas em sistemas de aquecimento, fornos e motores para gerar energia.
- Oxidação de metais:
- Quando os metais reagem com o oxigénio, como o ferro, para formar ferrugem, trata-se de uma reação exotérmica em que é libertado calor.
- Explosivos químicos:
- As explosões em explosivos químicos são reacções exotérmicas em que grandes quantidades de energia são libertadas sob a forma de calor e pressão.
As reacções endotérmicas absorvem calor do ambiente. Embora sejam essenciais para processos como a fotossíntese e a cozedura, têm geralmente um impacto direto menor no ambiente do que as reacções exotérmicas.
Outros exemplos de reacções endotérmicas:
- Fotossíntese:
- Na fotossíntese, as plantas absorvem o dióxido de carbono do ar e convertem-no em açúcar e oxigénio utilizando a energia da luz. Esta é uma reação endotérmica, uma vez que a energia é absorvida sob a forma de luz
- Água a ferver:
- O aquecimento da água até à ebulição é uma reação endotérmica. Durante o processo de ebulição, é adicionada energia sob a forma de calor para converter as partículas de água em vapor.
- Solução de sal em água:
- Quando o sal é dissolvido em água, as moléculas de sal absorvem o calor do ambiente para quebrar os cristais e dispersar-se na forma dissolvida.