Entalpia
Entalpia: una variabile misurata nell’analisi termica
Che cos’è l’entalpia?
L’entalpia di reazione è la variazione di entalpia di un campione durante una reazione chimica. Le reazioni in cui l’energia viene rilasciata sotto forma di calore sono dette esotermiche. Le reazioni in cui è necessario fornire energia sono dette endotermiche.
Le entalpie di fusione sono un semplice esempio di processi endotermici, in quanto di solito è necessario applicare calore a un sistema per rompere la sua struttura cristallina solida e convertirla in una fase liquida con molecole che possono muoversi liberamente l’una rispetto all’altra. Un esempio di reazione esotermica è un semplice processo di combustione in cui una sostanza reagisce con l’ossigeno, rilasciando energia.
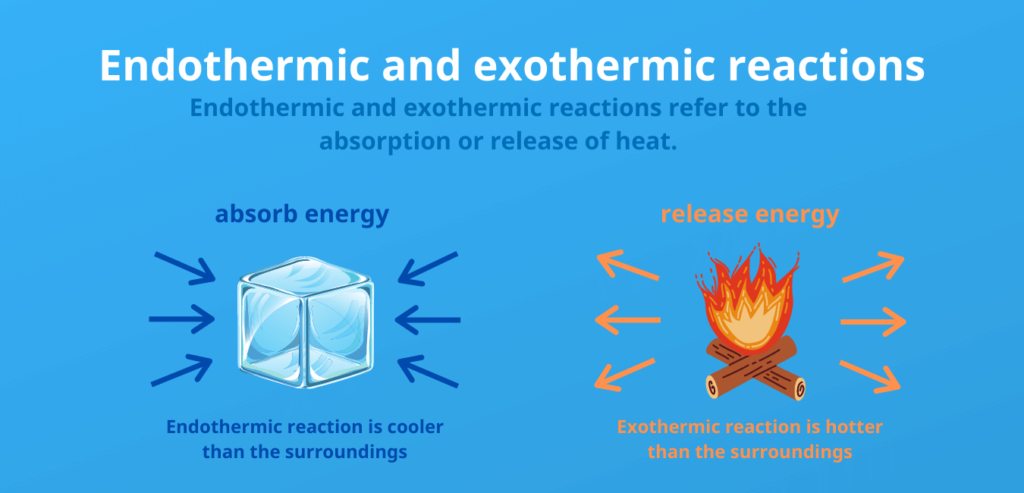
La differenza tra reazioni endotermiche ed esotermiche:
Endotermico:
- L’energia viene consumata (il calore viene assorbito)
- Energia consumata o richiesta per la reazione
- Aumento dell’entalpia interna
Esempi di processi endotermici sono
- Sciogliere i sali nei solventi
- Scissione degli alcani
- Vaporizzazione di liquidi
- Fusione di solidi
Esotermico:
- Viene rilasciata energia (viene rilasciato calore)
- La reazione è spontanea o innescata
- Diminuzione dell’entalpia interna
Esempi di processi esotermici:
- La reazione della termite
- Neutralizzazione (ad esempio mescolando un acido e una base per formare un sale e acqua)
- La maggior parte delle reazioni di polimerizzazione
- Combustione
- Respirazione
- Corrosione dei metalli (una reazione di ossidazione)
- La maggior parte dei processi di cristallizzazione
