Índice
Introdução: A importância da estabilidade das proteínas
A compreensão da estabilidade das proteínas é fundamental para a bioquímica moderna, a investigação farmacêutica e a biotecnologia. A estabilidade das proteínas determina não só o tempo que uma proteína terapêutica pode permanecer ativa em solução, mas também a sua adequação à formulação, armazenamento e transporte (Wang 1999). Desde a engenharia enzimática até ao desenvolvimento de medicamentos e estudos de biologia estrutural, a capacidade de avaliar e otimizar com precisão a estabilidade das proteínas permite aos investigadores e inovadores avançar nas aplicações das ciências da vida, minimizando os riscos devidos à agregação, desnaturação ou perda de atividade.
Publicações recentes sublinham o papel da estabilidade das proteínas na formulação de medicamentos e no bioprocessamento – onde mesmo pequenas alterações na composição do tampão ou na temperatura podem afetar profundamente a dobragem das proteínas e os resultados terapêuticos (Durowoju et al. 2017).
Factores que influenciam a estabilidade das proteínas
A função das proteínas depende criticamente da integridade da sua estrutura tridimensional – a conformação nativa. Esta estrutura pode ser perturbada por uma variedade de factores físico-químicos:
- Temperatura: As temperaturas elevadas podem desdobrar as proteínas, causando perda irreversível da sua função ou agregação.
- pH: As alterações do pH perturbam as interações iónicas e as ligações de hidrogénio, afectando a estabilidade estrutural.
- Força iónica: Os sais podem estabilizar ou desestabilizar as proteínas, dependendo das interações específicas com as cadeias laterais carregadas.
- Ligação de ligandos: Pequenas moléculas, cofactores ou fármacos que se ligam a proteínas podem estabilizar ou desestabilizar conformações específicas (Durowoju et al. 2017).
- Mutações genéticas: As mutações de ponto único podem aumentar ou reduzir a estabilidade, influenciando o comportamento da proteína em condições fisiológicas.
Estudos sistemáticos revelam que o ajuste da química dos tampões e o controlo da temperatura durante o manuseamento e o armazenamento estão entre as intervenções mais eficazes para preservar a atividade das proteínas (Wang 1999).
Fundamentos: O que significa a estabilidade das proteínas?
A estabilidade das proteínas refere-se à resistência da estrutura nativa de uma proteína em várias condições. Abrange:
- Estabilidade termodinâmica: A tendência de uma proteína para se manter dobrada em vez de desnaturar.
- Estabilidade cinética: A taxa a que uma proteína transita para um estado desdobrado ou agregado.
- Alterações reversíveis: Algumas transições de dobragem podem ser revertidas através do restabelecimento de condições benignas (por exemplo, redobragem após desnaturação ligeira).
- Alterações irreversíveis: O processamento severo (por exemplo, altas temperaturas ou agentes químicos) pode levar à agregação ou desdobramento que não pode ser revertido.
A estabilidade é frequentemente quantificada pela temperatura de fusão (Tm), na qual metade da população de proteínas é desnaturada – um parâmetro-chave medido em ensaios de estabilidade (Durowoju et al. 2017).
Métodos para avaliar a estabilidade das proteínas
Foram desenvolvidas várias técnicas ortogonais para estudar a estabilidade e as interações biomoleculares. A seleção do método adequado depende da questão de investigação, do tipo de proteína e da instrumentação disponível.
Calorimetria Exploratória Diferencial (DSC)
DSC é uma ferramenta essencial para estudos precisos de estabilidade em proteínas (Durowoju et al. 2017). Ao medir o calor necessário para desdobrar uma amostra de proteína à medida que a temperatura aumenta, a DSC determina:
- Temperatura de desnaturação (Tm): Indica a estabilidade térmica.
- Alterações de entalpia (ΔH): Revela transições de energia de dobragem.
- Perfis de desdobramento: Caracteriza transições reversíveis ou irreversíveis.
DSC é valorizado pela sua precisão na deteção de transições subtis – mesmo para proteínas em baixas concentrações – e é especialmente poderoso para caraterizar variantes, comportamento de formulação térmica e alterações de estabilidade induzidas por ligandos (Qualificação de um Método DSC 2020) .
Outros métodos analíticos
Espalhamento de luz dinâmico (DLS): Mede o raio hidrodinâmico e detecta a agregação de proteínas, complementando estabilidade térmica estabilidade térmica (Mirasol et al. 2021).
Espectroscopia UV-Vis: Monitoriza o desdobramento através do rastreio de alterações na absorvância relacionadas com cadeias laterais aromáticas ou cromóforos.
Calorimetria de titulação isotérmica (ITC): Quantifica as interações de ligação entre proteínas e ligandos; útil para detetar alterações de estabilidade após associação de ligandos (Durowoju et al. 2017).
Espectroscopia de dicroísmo circular (CD): Sonda as alterações da estrutura secundária durante a dobragem ou desnaturação (por exemplo, transições de alfa-hélice para folha beta).
Estudo das interações que afectam a estabilidade
As proteínas interagem continuamente com o seu ambiente molecular. A avaliação da forma como estas interações afectam a estabilidade é essencial para a investigação e o desenvolvimento:
- Ligação de ligandos: A DSC e a ITC são utilizadas para determinar as afinidades de ligação e os efeitos estabilizadores ou desestabilizadores de pequenas moléculas, fármacos e cofactores (Durowoju et al. 2017)
- Agregação de proteínas: A DLS identifica alterações na propensão de agregação durante a exposição ao calor ou ao stress (Wang 1999).
- Dependência de pH: Ao realizar execuções de DSC em diferentes valores de pH, os investigadores obtêm informações sobre o papel dos estados de protonação na dobragem.
- Variantes genéticas: A comparação dos perfis de Tm ou de agregação através de DSC e DLS permite avaliar a estabilidade conferida por mutações pontuais ou alterações de sequência projectadas (Mirasol et al. 2021).
Como os métodos térmicos iluminam as interações moleculares
Técnicas térmicas como DSC não só produzem Tm e entalpia, mas também, quando combinadas com protocolos de titulação de ligantes ou tampões, fornecem informações profundas sobre afinidades de ligação e estabilização estrutural (Durowoju et al. 2017). Por exemplo, um ligando que aumenta a Tm de uma proteína sugere uma interação estabilizadora direta relevante para a conceção ou formulação de medicamentos.
Perspectivas práticas e parâmetros de medição
A interpretação dos dados de estabilidade das proteínas requer atenção às condições experimentais e aos resultados típicos:
- Taxa de aquecimento: Influencia a deteção de estabilidade cinética vs. termodinâmica; taxas mais lentas favorecem as medições de equilíbrio.
- Concentração da amostra: Uma concentração suficiente garante um sinal fiável sem interferências de agregação.
- Composição do tampão: Compara os efeitos estabilizadores de diferentes tampões e excipientes na Tm e na entalpia de desdobramento (Wang 1999).
- Amostras de controlo: Compara sempre com padrões bem definidos – tais como proteínas de tipo selvagem vs. proteínas mutantes ou controlos apenas com tampão.
Aplicação
Exemplos de aplicações
- Comparação dos perfis de estabilidade de anticorpos monoclonais para o desenvolvimento de formulações (Qualificação de um DSC Método 2020).
- Avaliação de variantes de enzimas para biocatálise industrial que requerem resiliência térmica.
- Rastreio das afinidades de ligação proteína-ligando na fase inicial da descoberta de medicamentos e na biologia estrutural (Durowoju et al. 2017).
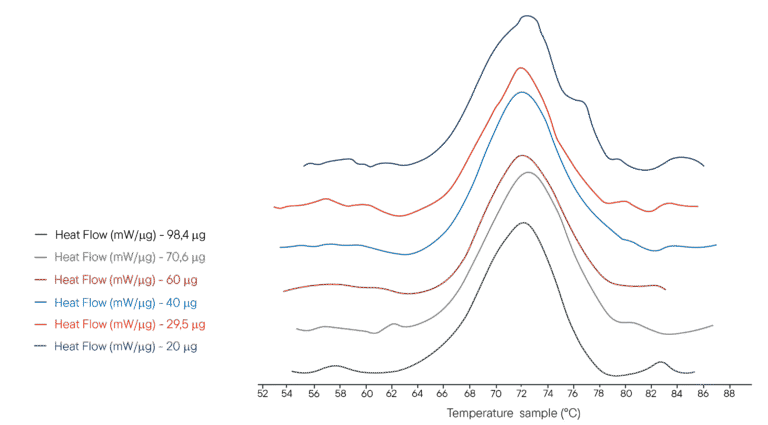
Exemplo de aplicação: Desnaturação térmica da lisozima
100µL of several solutions of lysozyme in PHB buffer were placed in a 100µL crucible. Different concentrations were used, representing different masses of lysozyme analysed respectively. The reference crucible was filled with the same volume of PHB buffer. The Ultimate DSC was programmed to perform a temperature ramp from 40°C to 95°C at 1°C/min.
Os termogramas obtidos são apresentados à direita. O Ultimate DSC permite medir a entalpia e a temperatura de desnaturação da lisozima utilizando menos 5 a 10 amostras do que os instrumentos atualmente disponíveis. Cada termograma foi obtido em menos de 60 minutos, permitindo uma análise rápida. O Ultimate DSC poupa grandes quantidades de amostra e permite-te trabalhar mais rapidamente.
Selecionar o método certo para a tua investigação
A escolha do método analítico ideal depende da tua proteína específica, do teu objetivo de investigação e dos recursos disponíveis:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
Para uma comparação detalhada, revisões recentes destacam como a integração de múltiplas técnicas, incluindo medições calorimétricas e espectroscópicas precisas, leva a uma avaliação robusta da estabilidade da proteína e da adequação para aplicações a jusante (Mirasol et al. 2021; Durowoju et al. 2017).
Conclusão e próximos passos
Compreender e controlar a estabilidade das proteínas é fundamental para o sucesso da investigação de biomoléculas, formulação farmacêutica e desenvolvimento de medicamentos. A análise térmica, particularmente utilizando DSC, fornece informações robustas e quantificáveis sobre o comportamento das proteínas em condições práticas, ajudando-o a tomar decisões baseadas em dados com confiança.
Se pretendes avançar nas tuas investigações de estabilidade de proteínas, o Linseis UDSC L64 fornece o estado-da-arte em calorimétrica de última geração para análise biomolecular e desenvolvimento de formulações. Descobre mais sobre o desempenho e o espetro versátil de aplicações do UDSC L64 na nossa página de soluções de calorimetria, ou contacta a nossa equipa especializada para uma consulta individualizada sobre as tuas necessidades de investigação.
Literatura selecionada para leitura adicional
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. e Kirkitadze, M. (2017) Differential Scanning Calorimetry-A Method for Assessing the Thermal Stability of Proteins, Journal of Visualized Experiments, (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- Wang, W. (1999) “Instability, stabilization, and formulation of liquid protein pharmaceuticals”, International Journal of Pharmaceutics, 185(2), pp. 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. e Kopec, B. (2021) Stability Testing of Protein Therapeutics Using DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- Qualificação de um Método de Calorimetria Exploratória Diferencial para Caracterização Biofísica de Anticorpos Monoclonais (Acesso Aberto). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf