Descrição do
Vai direto ao assunto
Diferença entre vapor de água e humidade relativa na análise térmica
Quando a água é aquecida até ao seu ponto de ebulição ou acima, muda o seu estado físico de líquido para gasoso. Fica então presente como vapor (de água). Se este vapor for introduzido numa câmara de reação ou num dispositivo, é designado por aplicação de vapor de água.
Em contrapartida, todos os gases podem transportar e conter uma certa quantidade de água a uma determinada temperatura. Isto é conhecido como humidade. Utilizando o ar como exemplo, é possível determinar que, mesmo abaixo do ponto de ebulição da água, existe sempre uma certa quantidade de água no ar, o que é conhecido como grau de humidade ou humidade relativa é designado por humidade relativa.
Ao contrário da humidade relativa, a água acima do ponto de ebulição dependente da pressão, que é de 100°C ao nível do mar, está presente apenas na sua fase gasosa, sob a forma de vapor de água. Misturando o vapor de água, que é gerado num gerador de vapor de água, com um gás de arrastamento como o ar, o azoto ou o hélio, a concentração (em vol%, wt% ou ppm) do vapor de água na amostra de gás pode ser ajustada de forma variável nos nossos analisadores.
Além disso, a atmosfera de gás no dispositivo pode ser estática ou dinâmica, consoante a aplicação. Os ensaios típicos para atmosferas dinâmicas de vapor de água incluem o aquecimento isotérmico de uma amostra e a dosagem subsequente de uma concentração definida de vapor de água para iniciar uma reação. Isto pode envolver, por exemplo, medições de adsorção, dessorção, redução, oxidação ou conversão.
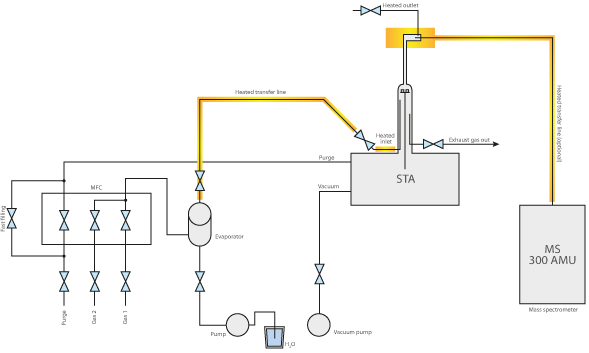
Na análise térmica, os geradores de vapor de água são normalmente utilizados em combinação com termobalanços como o TGA e o STA (na gama de alta pressão) e dilatómetros são utilizados.
Medições dependentes da pressão numa atmosfera de vapor de água
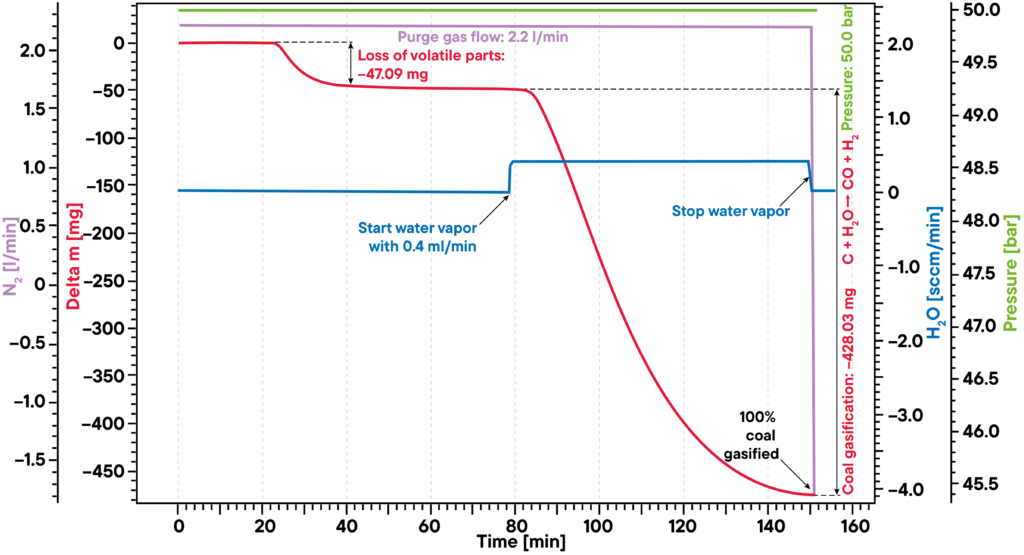
Para além da concentração e da temperatura, o nível de pressão da atmosfera também pode ser controlado, uma vez que tem uma grande influência na experiência. Um nível de pressão elevado é particularmente interessante para alterar as condições de equilíbrio das reacções, por exemplo, na gaseificação do carvão ou da biomassa, que podem ser investigadas com os nossos analisadores STA de alta pressão.
No entanto, à medida que o nível de pressão aumenta, devem também ser tidas em conta novas condições de fronteira. Por exemplo, o ponto de ebulição desloca-se para temperaturas mais elevadas à medida que o nível de pressão aumenta, até atingir o chamado ponto crítico.
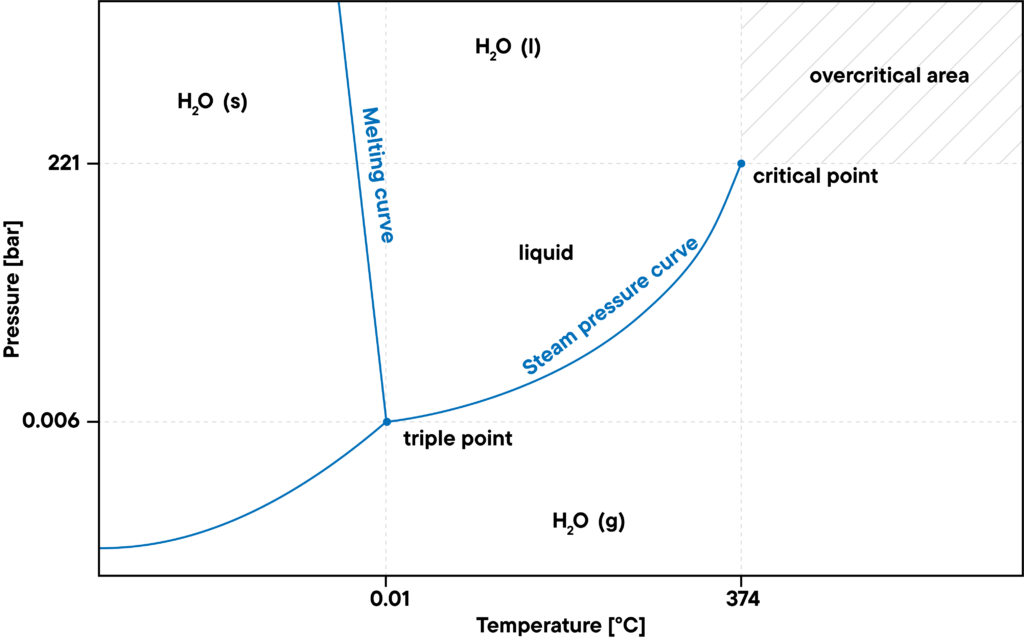
Por outro lado, o nível máximo de pressão da água gasosa é definido pela curva da pressão de vapor de saturação. Se a pressão for demasiado elevada, a água condensa-se. A temperaturas ou pressões mais elevadas, acima do ponto crítico, a densidade da água líquida é tão elevada como a da água gasosa, pelo que já não se pode condensar. Esta situação é designada por estado supercrítico, por exemplo, vapor de água superaquecido.
Tens dúvidas? Telefona-nos!
+49 (0) 9287/880 0
quinta-feira das 8 às 16 horas
e sexta-feira das 8 às 12 horas.
Estamos aqui para ti!
Aplicações
Bem informado


