Índice
Introducción: La importancia de la estabilidad de las proteínas
Comprender la estabilidad de las proteínas es fundamental para la bioquímica moderna, la investigación farmacéutica y la biotecnología. La estabilidad de las proteínas determina no sólo cuánto tiempo puede permanecer activa una proteína terapéutica en solución, sino también su idoneidad para la formulación, el almacenamiento y el transporte (Wang 1999). Desde la ingeniería enzimática hasta el desarrollo de fármacos y los estudios de biología estructural, la capacidad de evaluar con precisión y optimizar la estabilidad de las proteínas permite a los investigadores e innovadores avanzar en las aplicaciones de las ciencias de la vida minimizando los riesgos debidos a la agregación, desnaturalización o pérdida de actividad.
Publicaciones recientes subrayan el papel de la estabilidad de las proteínas en la formulación de fármacos y el bioprocesamiento, donde incluso pequeños cambios en la composición de los tampones o en la temperatura pueden afectar profundamente al plegamiento de las proteínas y a los resultados terapéuticos (Durowoju et al. 2017).
Factores que influyen en la estabilidad de las proteínas
La función de las proteínas depende en gran medida de la integridad de su estructura tridimensional: la conformación nativa. Esta estructura puede verse alterada por diversos factores fisicoquímicos:
- Temperatura: Las temperaturas elevadas pueden desdoblar las proteínas, provocando la pérdida irreversible de su función o su agregación.
- El pH: Los cambios de pH alteran las interacciones iónicas y los enlaces de hidrógeno, lo que afecta a la estabilidad estructural.
- Fuerza iónica: Las sales pueden estabilizar o desestabilizar las proteínas en función de las interacciones específicas con las cadenas laterales cargadas.
- Unión del ligando: Las moléculas pequeñas, los cofactores o los fármacos que se unen a las proteínas pueden estabilizar o desestabilizar conformaciones específicas (Durowoju et al. 2017).
- Mutaciones genéticas: Las mutaciones puntuales pueden aumentar o reducir la estabilidad, influyendo en el comportamiento de la proteína en condiciones fisiológicas.
Los estudios sistemáticos revelan que ajustar la química de los tampones y controlar la temperatura durante la manipulación y el almacenamiento son algunas de las intervenciones más eficaces para preservar la actividad de las proteínas (Wang 1999).
Fundamentos: ¿Qué significa estabilidad de las proteínas?
La estabilidad proteínica se refiere a la resistencia de la estructura nativa de una proteína en diversas condiciones. Abarca:
- Estabilidad termodinámica: Tendencia de una proteína a permanecer plegada en lugar de desnaturalizarse.
- Estabilidad cinética: La velocidad a la que una proteína pasa a un estado desplegado o agregado.
- Cambios reversibles: Algunas transiciones de plegamiento pueden revertirse restableciendo condiciones benignas (por ejemplo, el nuevo plegamiento tras una desnaturalización leve).
- Cambios irreversibles: El procesamiento severo (por ejemplo, altas temperaturas o agentes químicos) puede provocar agregación o desdoblamiento que no pueden revertirse.
La estabilidad suele cuantificarse por la temperatura de fusión (Tm), a la que se desnaturaliza la mitad de la población de proteínas, un parámetro clave medido en los ensayos de estabilidad (Durowoju et al. 2017).
Métodos para evaluar la estabilidad de las proteínas
Se han desarrollado múltiples técnicas ortogonales para estudiar la estabilidad y las interacciones biomoleculares. La selección del método adecuado depende de la pregunta de investigación, el tipo de proteína y la instrumentación disponible.
Calorimetría diferencial de barrido (DSC)
DSC es una herramienta esencial para realizar estudios precisos sobre la estabilidad de las proteínas (Durowoju et al. 2017). Midiendo el calor necesario para desplegar una muestra de proteína a medida que aumenta la temperatura, el DSC determina:
- Temperatura de desnaturalización (Tm): Indica la estabilidad térmica.
- Cambios de entalpía(ΔH): Revela las transiciones energéticas de plegamiento.
- Perfiles de desdoblamiento: Caracterizar las transiciones reversibles o irreversibles.
DSC se valora por su precisión en la detección de transiciones sutiles -incluso para proteínas a bajas concentraciones- y es especialmente potente para caracterizar variantes, el comportamiento de la formulación térmica y los cambios de estabilidad inducidos por ligandos (Cualificación de un método DSC 2020) .
Otros métodos analíticos
Dispersión dinámica de la luz (DLS): Mide el radio hidrodinámico y detecta la agregación de proteínas, complementando estabilidad térmica térmica (Mirasol et al. 2021).
Espectroscopia UV-Vis: Controla el desdoblamiento mediante el seguimiento de los cambios de absorbancia relacionados con las cadenas laterales aromáticas o los cromóforos.
Calorimetría de Titulación Isotérmica (ITC): Cuantifica las interacciones de unión entre proteínas y ligandos; útil para detectar cambios de estabilidad tras la asociación de ligandos (Durowoju et al. 2017).
Espectroscopia de dicroísmo circular (CD): Sondea los cambios de estructura secundaria durante el plegamiento o la desnaturalización (por ejemplo, transiciones de hélice alfa a lámina beta).
Estudio de las interacciones que afectan a la estabilidad
Las proteínas interactúan continuamente con su entorno molecular. Evaluar cómo afectan estas interacciones a la estabilidad es esencial para la investigación y el desarrollo:
- Unión de ligandos: El DSC y el ITC se utilizan para determinar las afinidades de unión y los efectos estabilizadores o desestabilizadores de pequeñas moléculas, fármacos y cofactores (Durowoju et al. 2017)
- Agregación de proteínas: La DLS identifica los cambios en la propensión a la agregación durante la exposición al calor o al estrés (Wang 1999).
- Dependencia del pH: Al realizar series de DSC a distintos valores de pH, los investigadores obtienen información sobre el papel de los estados de protonación en el plegamiento.
- Variantes genéticas: Comparar la Tm o los perfiles de agregación mediante DSC y DLS permite evaluar la estabilidad conferida por mutaciones puntuales o cambios en la secuencia de ingeniería (Mirasol et al. 2021).
Cómo los métodos térmicos iluminan las interacciones moleculares
Técnicas térmicas como DSC no sólo proporcionan la Tm y la entalpía, sino que, cuando se combinan con protocolos de valoración de ligandos o tampones, proporcionan una visión profunda de las afinidades de unión y la estabilización estructural (Durowoju et al. 2017). Por ejemplo, un ligando que aumenta la Tm de una proteína sugiere una interacción estabilizadora directa relevante para el diseño o la formulación de fármacos.
Ideas prácticas y parámetros de medición
La interpretación de los datos de estabilidad de las proteínas requiere prestar atención a las condiciones experimentales y a los resultados típicos:
- Velocidad de calentamiento: Influye en la detección de la estabilidad cinética frente a la termodinámica; las velocidades más lentas favorecen las mediciones de equilibrio.
- Concentración de la muestra: Una concentración suficiente garantiza una señal fiable sin interferencias de agregación.
- Composición del tampón: Compara los efectos estabilizadores de diferentes tampones y excipientes sobre la Tm y la entalpía de desdoblamiento (Wang 1999).
- Muestras de control: Compáralas siempre con estándares bien definidos, como proteínas de tipo salvaje frente a mutantes o controles de sólo tampón.
Aplicación
Ejemplos de aplicaciones
- Comparación de perfiles de estabilidad de anticuerpos monoclonales para el desarrollo de formulaciones (Cualificación de un DSC Método 2020).
- Evaluación de variantes enzimáticas para la biocatálisis industrial que requiere resistencia térmica.
- Cribado de afinidades de unión proteína-ligando en la fase inicial del descubrimiento de fármacos y la biología estructural (Durowoju et al. 2017).
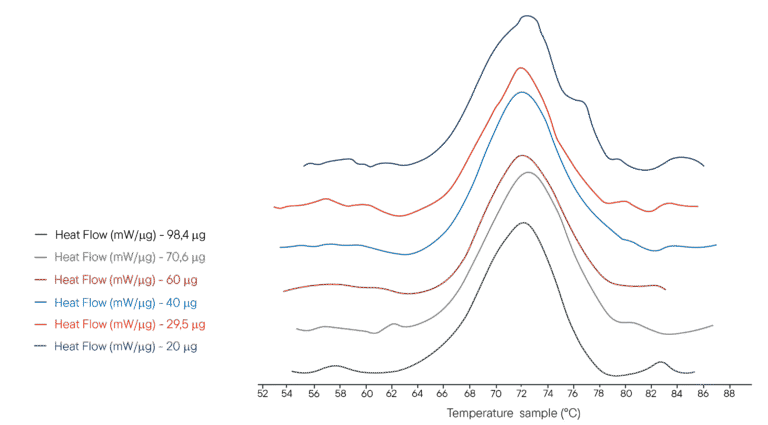
Ejemplo de aplicación: Desnaturalización térmica de la lisozima
100µL of several solutions of lysozyme in PHB buffer were placed in a 100µL crucible. Different concentrations were used, representing different masses of lysozyme analysed respectively. The reference crucible was filled with the same volume of PHB buffer. The Ultimate DSC was programmed to perform a temperature ramp from 40°C to 95°C at 1°C/min.
Los termogramas obtenidos se muestran a la derecha.El Ultimate DSC permite medir la entalpía y la temperatura de desnaturalización de la Lisozima utilizando de 5 a 10 muestras menos que los instrumentos disponibles actualmente. Cada termograma se obtuvo en menos de 60 minutos, lo que permite un análisis rápido. El Ultimate DSC ahorra grandes cantidades de muestra y te permite trabajar más rápido.
Seleccionar el método adecuado para tu investigación
La elección del método analítico óptimo depende de tu proteína específica, del objetivo de la investigación y de los recursos disponibles:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
Para una comparación detallada, en revisiones recientes se destaca cómo la integración de múltiples técnicas, incluidas las mediciones calorimétricas y espectroscópicas precisas, conduce a una evaluación sólida de la estabilidad de las proteínas y de su idoneidad para aplicaciones posteriores (Mirasol et al. 2021; Durowoju et al. 2017).
Conclusión y próximos pasos
Comprender y controlar la estabilidad de las proteínas es fundamental para el éxito de la investigación de biomoléculas, la formulación farmacéutica y el desarrollo de fármacos. El análisis térmico, en particular mediante DSC, proporciona información sólida y cuantificable sobre el comportamiento de las proteínas en condiciones prácticas, ayudándote a tomar decisiones basadas en datos con confianza.
Si buscas avanzar en tus investigaciones sobre la estabilidad de las proteínas, el Linseis UDSC L64 ofrece la tecnología calorimétrico a medida para el análisis biomolecular y el desarrollo de formulaciones. Descubre más sobre el rendimiento y el versátil espectro de aplicaciones del UDSC L64 en nuestra página de soluciones calorimétricas, o ponte en contacto con nuestro equipo especializado para una consulta individualizada sobre tus necesidades de investigación.
Bibliografía seleccionada para lecturas complementarias
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. y Kirkitadze, M. (2017) Calorimetría diferencial de barrido: un método para evaluar la estabilidad térmica de las proteínas, Journal of Visualized Experiments, (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- Wang, W. (1999) «Inestabilidad, estabilización y formulación de productos farmacéuticos proteicos líquidos», International Journal of Pharmaceutics, 185(2), pp. 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. y Kopec, B. (2021) Stability Testing of Protein Therapeutics Using DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- Cualificación de un Método de Calorimetría Diferencial de Barrido para la Caracterización Biofísica de Anticuerpos Monoclonales (Acceso Abierto). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf