Indice dei contenuti
Introduzione: L'importanza della stabilità delle proteine
La comprensione della stabilità delle proteine è fondamentale per la biochimica moderna, la ricerca farmaceutica e la biotecnologia. La stabilità delle proteine determina non solo il tempo in cui una proteina terapeutica può rimanere attiva in soluzione, ma anche la sua idoneità alla formulazione, alla conservazione e al trasporto (Wang 1999). Dall’ingegneria enzimatica allo sviluppo di farmaci e agli studi di biologia strutturale, la capacità di valutare con precisione e ottimizzare la stabilità delle proteine consente a ricercatori e innovatori di far progredire le applicazioni delle scienze della vita riducendo al minimo i rischi dovuti all’aggregazione, alla denaturazione o alla perdita di attività.
Recenti pubblicazioni sottolineano il ruolo della stabilità delle proteine nella formulazione di farmaci e nel bioprocesso, dove anche piccoli cambiamenti nella composizione del tampone o nella temperatura possono influenzare profondamente il ripiegamento delle proteine e i risultati terapeutici (Durowoju et al. 2017).
Fattori che influenzano la stabilità delle proteine
La funzione delle proteine dipende in modo critico dall’integrità della loro struttura tridimensionale, la conformazione nativa. Questa struttura può essere perturbata da una serie di fattori fisico-chimici:
- Temperatura: Le temperature elevate possono dispiegare le proteine, causando la perdita irreversibile della loro funzione o l’aggregazione.
- pH: Le variazioni di pH alterano le interazioni ioniche e i legami idrogeno, incidendo sulla stabilità strutturale.
- Forza ionica: I sali possono stabilizzare o destabilizzare le proteine a seconda delle interazioni specifiche con le catene laterali cariche.
- Legame con i ligandi: Piccole molecole, cofattori o farmaci che si legano alle proteine possono stabilizzare o destabilizzare specifiche conformazioni (Durowoju et al. 2017).
- Mutazioni genetiche: Le mutazioni di un singolo punto possono aumentare o ridurre la stabilità, influenzando il comportamento della proteina in condizioni fisiologiche.
Studi sistematici rivelano che la regolazione della chimica dei tamponi e il controllo della temperatura durante la manipolazione e la conservazione sono tra gli interventi più efficaci per preservare l’attività delle proteine (Wang 1999).
Fondamenti: Cosa significa stabilità delle proteine?
La stabilità delle proteine si riferisce alla resistenza della struttura nativa di una proteina in varie condizioni. Comprende:
- Stabilità termodinamica: La tendenza di una proteina a rimanere ripiegata piuttosto che denaturarsi.
- Stabilità cinetica: La velocità con cui una proteina passa allo stato dispiegato o aggregato.
- Cambiamenti reversibili: Alcune transizioni di ripiegamento possono essere invertite ripristinando condizioni favorevoli (ad esempio, il ripiegamento dopo una leggera denaturazione).
- Cambiamenti irreversibili: Un trattamento severo (ad esempio, temperature elevate o agenti chimici) può portare all’aggregazione o al dispiegamento che non può essere invertito.
La stabilità è spesso quantificata dalla temperatura di fusione (Tm), alla quale metà della popolazione proteica è denaturata, un parametro chiave misurato nei saggi di stabilità (Durowoju et al. 2017).
Metodi per valutare la stabilità delle proteine
Sono state sviluppate diverse tecniche ortogonali per studiare la stabilità e le interazioni biomolecolari. La scelta del metodo più adatto dipende dalla domanda di ricerca, dal tipo di proteina e dalla strumentazione disponibile.
Calorimetria a scansione differenziale (DSC)
LA DSC è uno strumento essenziale per studi precisi sulla stabilità delle proteine (Durowoju et al. 2017). By measuring the heat required to unfold a protein sample as temperature increases, DSC determines:
- Temperatura di denaturazione (Tm): Indica la stabilità termica.
- Variazioni di entalpia (ΔH): Rivela le transizioni energetiche di ripiegamento.
- Profili di dispiegamento: Caratterizzare le transizioni reversibili o irreversibili.
LA DSC è apprezzata per la sua precisione nel rilevare transizioni sottili, anche per le proteine a basse concentrazioni, ed è particolarmente potente per caratterizzare le varianti, il comportamento della formulazione termica e i cambiamenti di stabilità indotti dai ligandi (Qualification of a DSC Method 2020).
Altri metodi analitici
Diffusione dinamica della luce (DLS): Misura il raggio idrodinamico e rileva l’aggregazione delle proteine, completando la stabilità termica. stabilità termica (Mirasol et al. 2021).
Spettroscopia UV-Vis: Monitora il dispiegamento seguendo i cambiamenti di assorbanza legati alle catene laterali aromatiche o ai cromofori.
Calorimetria isotermica di titolazione (ITC): Quantifica le interazioni di legame tra proteine e ligandi; è utile per rilevare i cambiamenti di stabilità in seguito all’associazione dei ligandi (Durowoju et al. 2017).
Spettroscopia del dicroismo circolare (CD): Sonda i cambiamenti della struttura secondaria durante il ripiegamento o la denaturazione (ad esempio, le transizioni da alfa-elica a beta-foglio).
Studio delle interazioni che influenzano la stabilità
Le proteine interagiscono continuamente con il loro ambiente molecolare. Valutare come queste interazioni influenzino la stabilità è essenziale per la ricerca e lo sviluppo:
- Legame con i ligandi: La DSC e l’ITC vengono utilizzate per determinare l’affinità di legame e gli effetti stabilizzanti o destabilizzanti di piccole molecole, farmaci e cofattori (Durowoju et al. 2017).
- Aggregazione delle proteine: La DLS identifica i cambiamenti nella propensione all’aggregazione durante l’esposizione al calore o allo stress (Wang 1999).
- Dipendenza dal pH: Eseguendo analisi DSC a diversi valori di pH, i ricercatori possono capire il ruolo degli stati di protonazione nel ripiegamento.
- Varianti genetiche: Il confronto dei profili di Tm o di aggregazione tramite DSC e DLS permette di valutare la stabilità conferita da mutazioni puntiformi o cambiamenti di sequenza ingegnerizzati (Mirasol et al. 2021).
Come i metodi termici illuminano le interazioni molecolari
Tecniche termiche come DSC non solo producono Tm ed entalpia, ma, se combinate con protocolli di titolazione del ligando o del tampone, forniscono approfondimenti sull’affinità di legame e sulla stabilizzazione strutturale (Durowoju et al. 2017). Ad esempio, un ligando che aumenta la Tm di una proteina suggerisce un’interazione diretta stabilizzante rilevante per la progettazione o la formulazione di un farmaco.
Approfondimenti pratici e parametri di misurazione
Interpretare i dati sulla stabilità delle proteine richiede attenzione alle condizioni sperimentali e ai risultati tipici:
- Velocità di riscaldamento: Influenza il rilevamento della stabilità cinetica rispetto a quella termodinamica; le velocità più basse favoriscono le misurazioni di equilibrio.
- Concentrazione del campione: Una concentrazione sufficiente garantisce un segnale affidabile senza interferenze di aggregazione.
- Composizione del tampone: Confronta gli effetti stabilizzanti di diversi tamponi ed eccipienti sulla Tm e sull’entalpia di dispiegamento (Wang 1999).
- Campioni di controllo: Fai sempre un confronto con standard ben definiti, come ad esempio proteine wild type o mutanti o controlli solo con tampone.
Applicazione
Esempi di applicazioni
- Confronto tra i profili di stabilità degli anticorpi monoclonali per lo sviluppo di formulazioni (Qualificazione di una DSC Metodo 2020).
- Valutazione di varianti di enzimi per la biocatalisi industriale che richiedono resistenza termica.
- Lo screening delle affinità di legame proteina-ligando nelle fasi iniziali della scoperta di farmaci e della biologia strutturale (Durowoju et al. 2017).
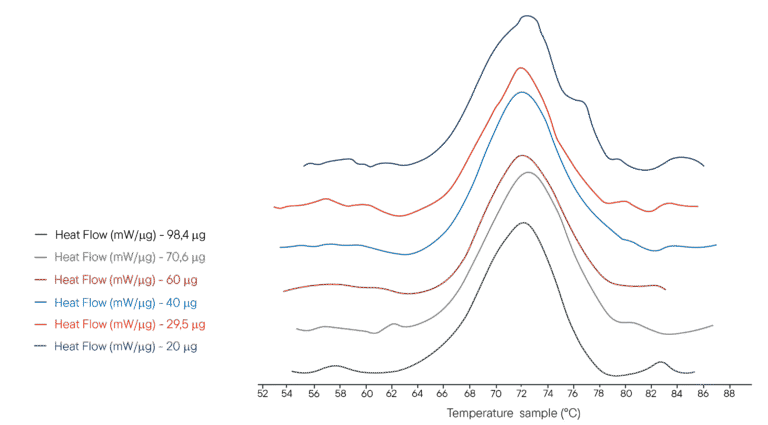
Esempio di applicazione: Denaturazione termica del lisozima
100µL of several solutions of lysozyme in PHB buffer were placed in a 100µL crucible. Different concentrations were used, representing different masses of lysozyme analysed respectively. The reference crucible was filled with the same volume of PHB buffer. The Ultimate DSC was programmed to perform a temperature ramp from 40°C to 95°C at 1°C/min.
L’Ultimate DSC permette di misurare l’entalpia e la temperatura di denaturazione del lisozima utilizzando da 5 a 10 campioni in meno rispetto agli strumenti attualmente disponibili. Ogni termogramma è stato ottenuto in meno di 60 minuti, consentendo un’analisi rapida. L’Ultimate DSC consente di risparmiare grandi quantità di campione e di lavorare più velocemente.
Scegliere il metodo giusto per la tua ricerca
La scelta del metodo analitico ottimale dipende dalla proteina specifica, dall’obiettivo della ricerca e dalle risorse disponibili:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
Per un confronto dettagliato, recenti recensioni evidenziano come l’integrazione di più tecniche, tra cui precise misurazioni calorimetriche e spettroscopiche, porti a una solida valutazione della stabilità delle proteine e dell’idoneità alle applicazioni a valle (Mirasol et al. 2021; Durowoju et al. 2017).
Conclusioni e passi successivi
La comprensione e il controllo della stabilità delle proteine sono fondamentali per il successo della ricerca sulle biomolecole, della formulazione farmaceutica e dello sviluppo di farmaci. L’analisi termica, in particolare l’uso della DSC, fornisce informazioni solide e quantificabili sul comportamento delle proteine in condizioni pratiche, aiutandoti a prendere decisioni basate sui dati con fiducia.
Se stai cercando di migliorare le tue ricerche sulla stabilità delle proteine, il Linseis UDSC L64 offre lo stato dell’arte calorimetrico per l’analisi biomolecolare e lo sviluppo di formulazioni. Scopri le prestazioni e il versatile spettro applicativo dell’UDSC L64 nella pagina dedicata alle soluzioni calorimetriche, oppure contatta il nostro team specializzato per una consulenza personalizzata sulle tue esigenze di ricerca.
Letteratura selezionata per ulteriori letture
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. e Kirkitadze, M. (2017) Differential Scanning Calorimetry-A Method for Assessing the Thermal Stability of Proteins, Journal of Visualized Experiments, (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- Wang, W. (1999) ‘Instability, stabilization, and formulation of liquid protein pharmaceuticals’, International Journal of Pharmaceutics, 185(2), pp. 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. e Kopec, B. (2021) Stability Testing of Protein Therapeutics Using DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- Qualificazione di un metodo di calorimetria differenziale a scansione per la caratterizzazione biofisica degli anticorpi monoclonali (Accesso libero). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf