Indice dei contenuti
Fasi della caratterizzazione dei materiali
Densità, durezza, capacità termica o conducibilità
Stato aggregato
Una fase è generalmente una composizione omogenea nel materiale. Il termine fase può riferirsi allo stato aggregato (solido, liquido o gassoso), ma anche alla struttura del reticolo cristallino all’interno di una determinata zona del solido o alle modifiche chimiche. È importante notare che una sostanza può esistere in diverse fasi allo stesso tempo.
Determinare le transizioni di fase
Per sapere in quale fase si trova un materiale e quindi quando si applicano i parametri, è particolarmente importante conoscere e determinare le transizioni di fase di un materiale. Queste si verificano normalmente quando si raggiunge una certa temperatura o un certo livello di energia, oppure sotto l’influenza di pressioni o reazioni chimiche.
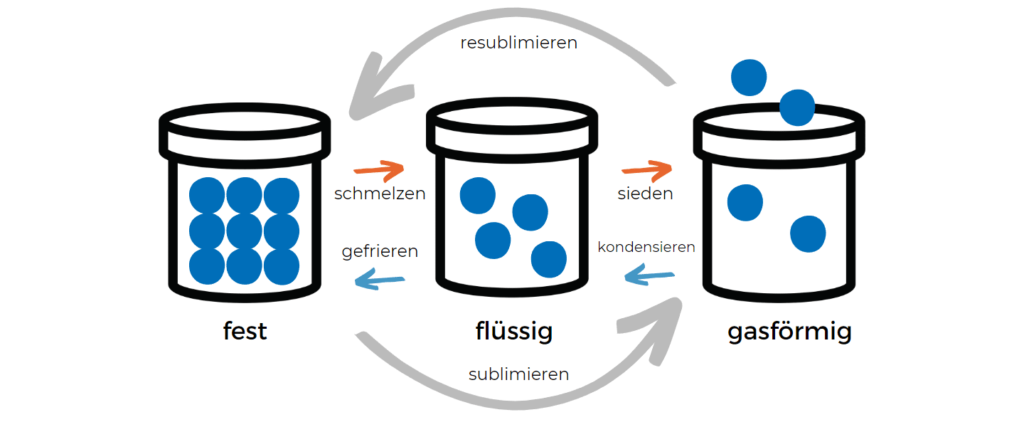
Quali transizioni di fase esistono?
Poiché esistono diverse definizioni di fasi (stato aggregato, struttura cristallina, modifica, ecc.), esistono anche diverse transizioni di fase. Nel caso più semplice, una transizione di fase descrive il puro cambiamento di uno stato aggregato, ad esempio da solido a liquido.
Le transizioni di fase vengono solitamente classificate secondo la cosiddetta classificazione di Ehrenfest, secondo Paul Ehrenfest.
Le variabili termodinamiche volume, entalpia o entropia sono solitamente considerate in funzione della temperatura.
Le transizioni di fase vengono poi classificate in cosiddetti ordini, in base ai quali l’ordine n-esimo della funzione della variabile in esame presenta una discontinuità nella derivata n-esima rispetto alla temperatura. La funzione stessa e la derivata n-1 sono continue. In pratica, si distingue solo tra transizioni di fase del 1° e del 2° ordine.
Esempi di transizioni di fase del 1° ordine sono
- Conversione tra stati di aggregazione solidi, liquidi e gassosi, in particolare
- Fusione (passaggio da solido a liquido)
- Vaporizzazione (passaggio da liquido a gas)
- Sublimazione (passaggio da solido a gassoso)
- Solidificazione o congelamento (passaggio da liquido a solido)
- Condensazione (passaggio da gassoso a liquido)
- Resublimazione (transizione da gassoso a solido)
Esempi di transizioni di fase del 2° ordine sono
- Cambiamento tra comportamento ferromagnetico e paramagnetico alla temperatura critica o di Curie
- Passaggio da un ordine magnetico all’altro, ad esempio da una struttura magnetica commensurabile a una incommensurabile.
- Cambiamento tra comportamento ferroelettrico e dielettrico
- Transizione alla superconduttività
Come posso misurare le transizioni di fase?
Le transizioni di fase vengono normalmente analizzate nell’analisi termica utilizzando un calorimetro a scansione differenziale DDK (calorimetro a scansione differenziale – DSC).
Se una sostanza presenta una transizione di fase nell’intervallo di temperatura misurato durante la misurazione con il DSC, ad esempio a causa di un cambiamento dello stato aggregato o della struttura cristallina, questa può essere facilmente rilevata con il DSC. La maggior parte delle transizioni di fase è accompagnata dall’assorbimento (endotermico) o dal rilascio (esotermico) di energia, che può essere rilevata come una variazione del flusso di calore.
Il DSC misura queste variazioni di temperatura utilizzando una o più termocoppie che sono in contatto con il supporto del campione e quindi confrontano la temperatura esatta del campione con la temperatura ambiente e con un campione di riferimento. Il flusso di calore esatto del campione in un determinato momento può quindi essere letto dalla differenza tra il campione di riferimento e il campione. In caso di differenza nel flusso di calore tra il campione e il riferimento, il segno della differenza indica la presenza di un processo endotermico o esotermico.
Anche la posizione dell’effetto che si verifica quando viene tracciato rispetto alla temperatura indica con precisione il momento in cui si verifica. Quanto più accuratamente viene misurata la temperatura esatta del campione, tanto migliore sarà la risoluzione e la sensibilità del DSC.
Nel caso delle transizioni di fase, soprattutto quelle di secondo ordine, la velocità di riscaldamento è molto importante per rilevare la transizione. Se la velocità di riscaldamento è troppo bassa, gli effetti sono spesso appena rilevabili, poiché la differenza di energia tra il campione e il riferimento viene compensata dal forno o dal riscaldatore. Se la velocità di riscaldamento è troppo alta, l’effetto diventa più visibile, ma viene anche spostato a temperature più elevate.