Tecnologia dell'idrogeno e analisi termica
Indice dei contenuti
Energia verde – Ciclo dell’idrogeno – Economia dell’idrogeno
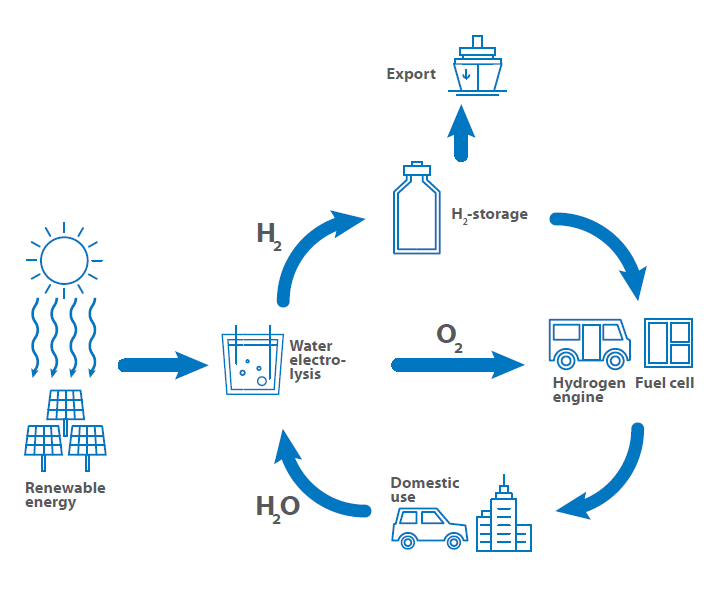
Una chiave essenziale per l’energia verde e la mobilità è l’uso dell’idrogeno come combustibile, per l’immagazzinamento di energia e per l’uso dell’idrogeno come carburante. l’immagazzinamento dell’energia e come strumento per i processi di trasferimento dell’energia. Per questo motivo, è stato definito il cosiddetto ciclo dell’idrogeno, che mostra l’utilizzo dell’idrogeno dalla produzione allo stoccaggio e all’esportazione fino all’utilizzo come combustibile, per poi tornare alla produzione.
Poiché esistono molti percorsi per ogni fase di questo ciclo, sono stati creati alcuni concetti di ricerca per colmare le lacune e accedere a tecniche necessarie e non ancora completamente sviluppate. L’Organizzazione di Ricerca Fraunhofer Organizzazione di Ricerca Fraunhofer ha sviluppato e pubblicato una roadmap sull’idrogeno per la Germania, in cui vengono presentate tutte le aree e i temi di ricerca.
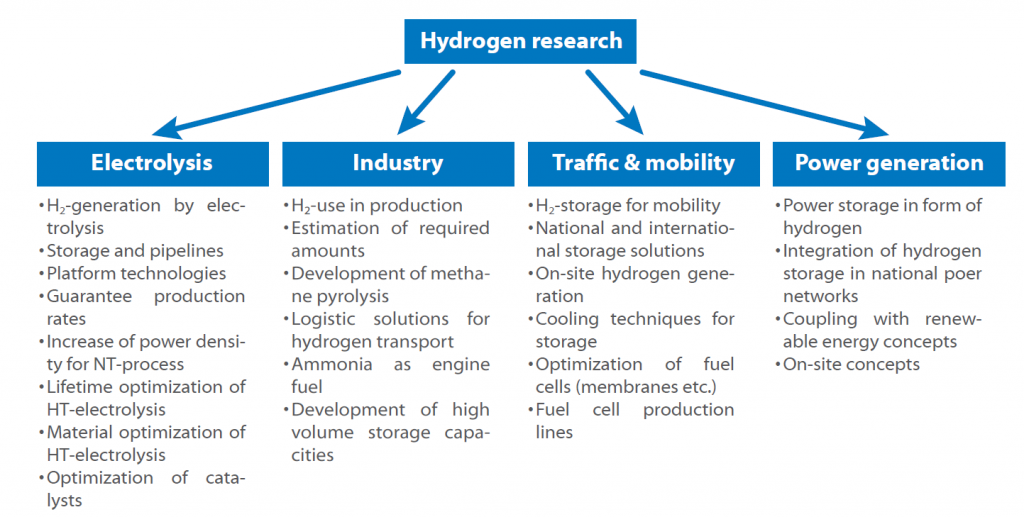
La tabella di marcia mostra i possibili utilizzi dell’idrogeno nel prossimo futuro. Il punto chiave è sempre lo stoccaggio e la produzione, poiché ogni settore è interessato dalla questione di come immagazzinare l’idrogeno in modo sicuro ed efficiente.
Un’altra domanda a cui bisogna rispondere è se sia più promettente la produzione di idrogeno centralizzata o decentralizzata e se debba essere utilizzato come combustibile direttamente o sotto forma di ammoniaca o sostanze simili.
1. ciclo dell’idrogeno – fonti di energia rinnovabili
Il ciclo dell’idrogeno inizia con la produzione di idrogeno da parte di centrali elettriche verdi. Le fonti più importanti per la produzione di energia rinnovabile sono le centrali idroelettriche, le turbine eoliche, i sistemi fotovoltaici, gli impianti geotermici e le centrali a biomassa, con l’obiettivo di generare energia in quantità sufficiente senza emissioni di CO2 e senza scorie nucleari.
Analisi termica e la scienza dei materiali sono presenti in tutte le aree:
- Dalla ricerca sui materiali compositi, come quelli utilizzati nelle pale delle turbine eoliche
- all’ottimizzazione dei materiali semiconduttori nelle celle fotovoltaiche
- all’ottimizzazione della produzione diretta di idrogeno dalle applicazioni della biomassa.

Esempio di applicazione: comportamento di espansione termica dei materiali leggeri
Un buon esempio di quando l’analisi termica entra in gioco nel campo delle energie rinnovabili è il comportamento di espansione termica di comportamento di espansione di materiali leggeri come i materiali compositi per le pale delle turbine eoliche:
I materiali compositi sono utilizzati nelle costruzioni leggere o come materiali speciali per molti scopi.
Ad esempio, le pale delle turbine eoliche sono realizzate con leghe di alluminio leggere o polimeri leggeri.
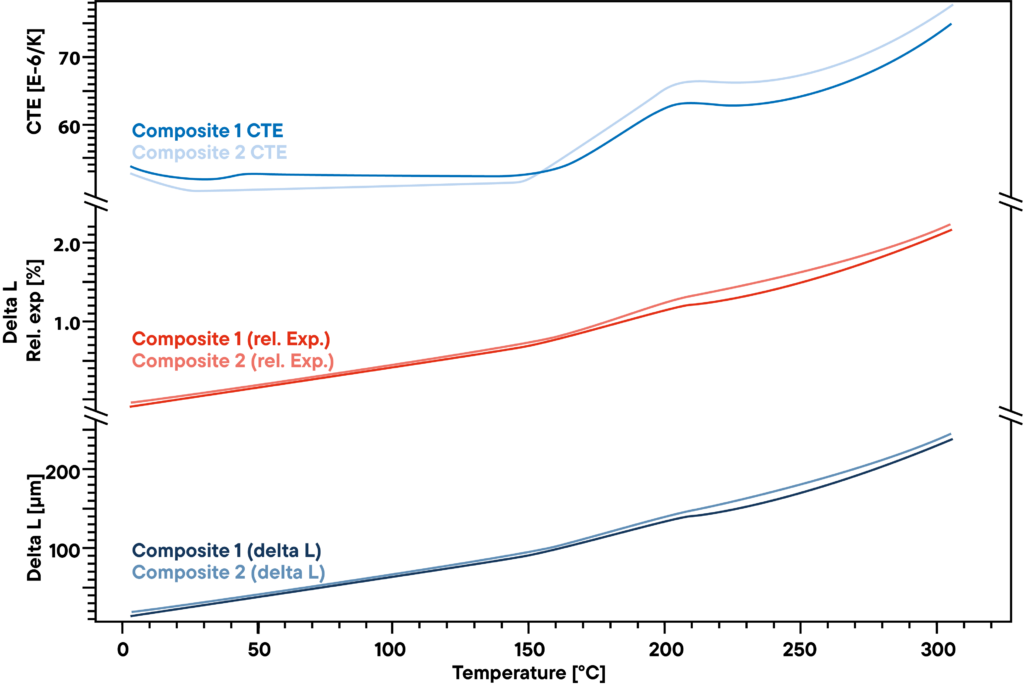
La misurazione mostra la piccola differenza tra due compositi polimerici utilizzati per strutture rigide ma leggere come le pale delle turbine eoliche. Il delta L assoluto, misurato con un dilatometro Linseis pushrod a una
Tuttavia, c’è una leggera differenza che diventa visibile osservando il CTE. Prima del punto di trasformazione a circa 200°C, c’è un piccolo effetto visibile solo in uno dei due campioni e indica un’altra piccola trasformazione o cambiamento di fase che l’altro materiale non mostra.
Esempio di applicazione: DEA – Analisi dielettrica / Monitoraggio della polimerizzazione
Per una produzione efficiente e di alta qualità dei materiali compositi, è di fondamentale importanza conoscere l’esatto profilo di tempo e temperatura necessario per completare un pezzo specifico.
Se questi parametri vengono selezionati in modo errato, la qualità non può essere raggiunta o si spreca denaro. Il processo di polimerizzazione può essere monitorato con la DEA – Analisi Dielettrica – se i tempi di attesa sono troppo lunghi.
La polimerizzazione della maggior parte dei polimeri può essere osservata con i sensori DEA, che vengono inseriti nel materiale non polimerizzato.
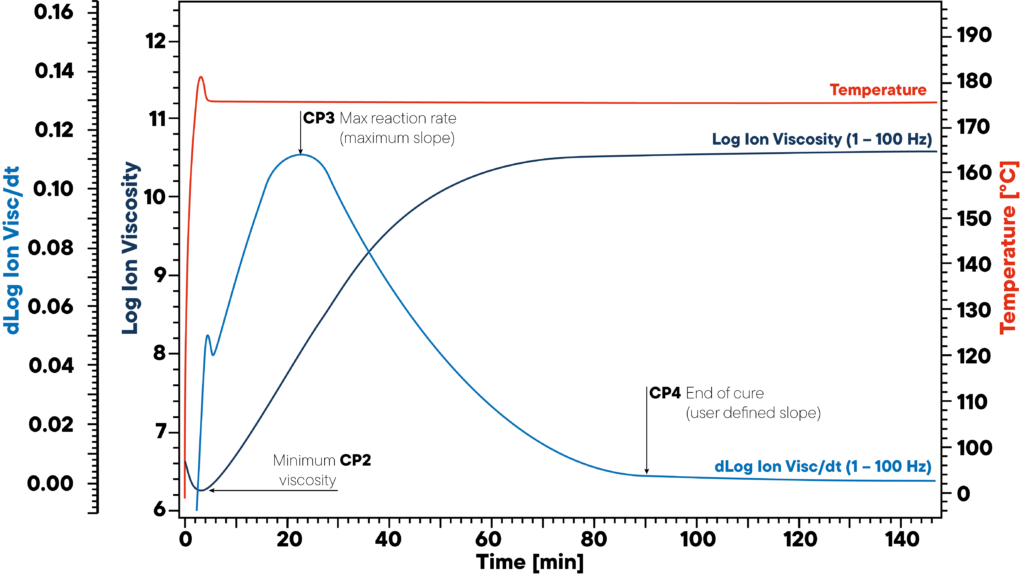
Nell’esempio, la resina viene riscaldata isotermicamente a 180 °C e viene collegato un sensore DEA. La curva rossa mostra la temperatura isoterma del campione e del sensore. Vengono monitorate la viscosità ionica e la pendenza della viscosità ionica.
I tre punti significativi CP2, CP3 e CP4 segnano l’inizio (viscosità minima), la massima velocità di reazione (pendenza massima) e la fine della polimerizzazione. Queste informazioni sono fondamentali per una corretta polimerizzazione del polimero, poiché i materiali non polimerizzati possono causare gravi problemi di qualità.
Esempio di applicazione: qualità e comportamento delle materie prime, ad esempio la biomassa.
Un altro punto importante per la produzione di idrogeno è la qualità e il comportamento delle materie prime, ad esempio la biomassa utilizzata per generare elettricità e idrogeno.
 La domanda è: quanto idrogeno si può ottenere da diverse materie prime durante la gassificazione, quanta energia è necessaria per farlo e qual è il risultato complessivo. Questo può essere monitorato tramite termogravimetria a pressione e termogravimetria e calorimetria combinate (STA), come mostrato nel seguente esempio di applicazione.
La domanda è: quanto idrogeno si può ottenere da diverse materie prime durante la gassificazione, quanta energia è necessaria per farlo e qual è il risultato complessivo. Questo può essere monitorato tramite termogravimetria a pressione e termogravimetria e calorimetria combinate (STA), come mostrato nel seguente esempio di applicazione.
Un’applicazione tipica delle misurazioni TGA ad alta pressione è l’indagine della cosiddetta gassificazione o idrogassificazione del carbone. Questo processo, in cui il carbone viene riscaldato in un’atmosfera di vapore acqueo, viene utilizzato nei processi catalitici, ad esempio per rimuovere il monossido di carbonio dai gas di scarico e soprattutto per estrarre preziosi composti organici da risorse come il carbone o la biomassa.
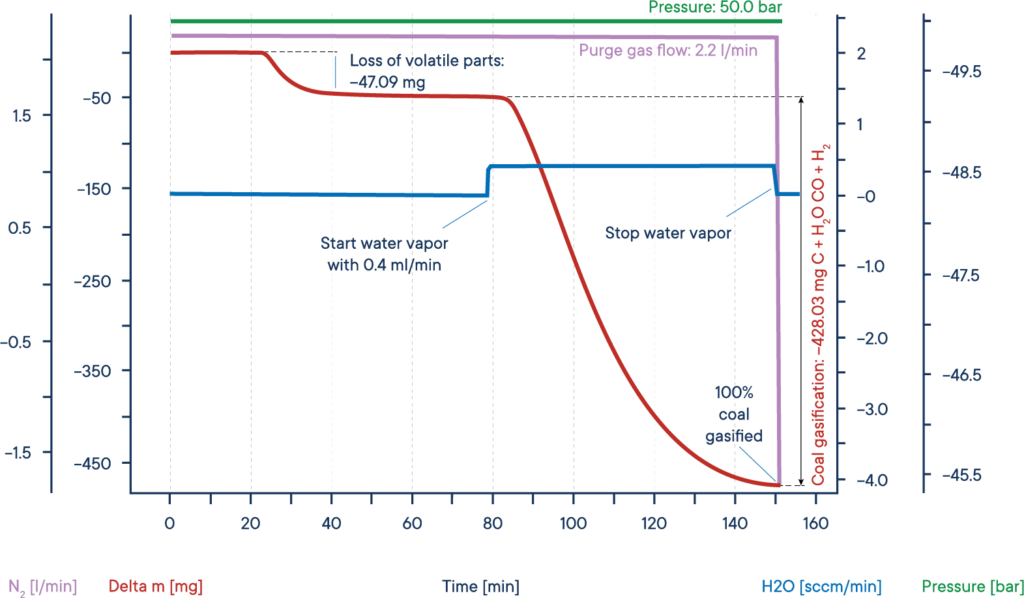
L’esempio riportato mostra un tipico test di gassificazione di una biomassa secca. Il campione di biomassa è stato riscaldato fino a raggiungere un plateau isotermico in un’atmosfera di azoto a una pressione di 50 bar ( TGA ad alta pressione – termobilancia ).
Il segnale di massa mostra la perdita di volatili tra i 20 e i 40 minuti. Dopo l’aggiunta di vapore acqueo, la biomassa è stata gassificata e consumata quasi completamente dopo 150 minuti, producendo H2, CO, CH3OH e altri gas reattivi utili, come mostrato nella curva di perdita di massa rossa.
L’intero processo può essere descritto come segue: Il carbonio reagisce con il vapore acqueo per formare una miscela di monossido di carbonio e idrogeno. Il monossido di carbonio risultante può reagire con una seconda molecola d’acqua per formare anidride carbonica e altro idrogeno; infine, l’idrogeno risultante può formare metano e altri idrocarburi dal monossido di carbonio.
Esempio di applicazione: Indagine sul comportamento di combustione e sul contenuto di ceneri dei materiali compositi
Infine, ma non meno importante, i materiali compositi devono essere riciclati o utilizzati a fini energetici al termine della vita utile del prodotto. A tal fine, potrebbe essere interessante studiare il comportamento di combustione e il contenuto di ceneri.
I materiali carboniosi, le sostanze organiche e i polimeri generalmente bruciano quando vengono riscaldati. Lo studio della decomposizione termica di questi materiali è quindi piuttosto specializzato. Nella maggior parte dei casi, viene effettuato in atmosfere inerti anziché in aria per osservare gli effetti di decomposizione e pirolisi, seguiti da uno scambio di gas con ossigeno o aria, che porta alla combustione del carbonio contenuto.
Se questo processo viene eseguito su un analizzatore termico combinato (STA), è possibile misurare il contenuto di carbonio, il contenuto inorganico e il calore rilasciato.
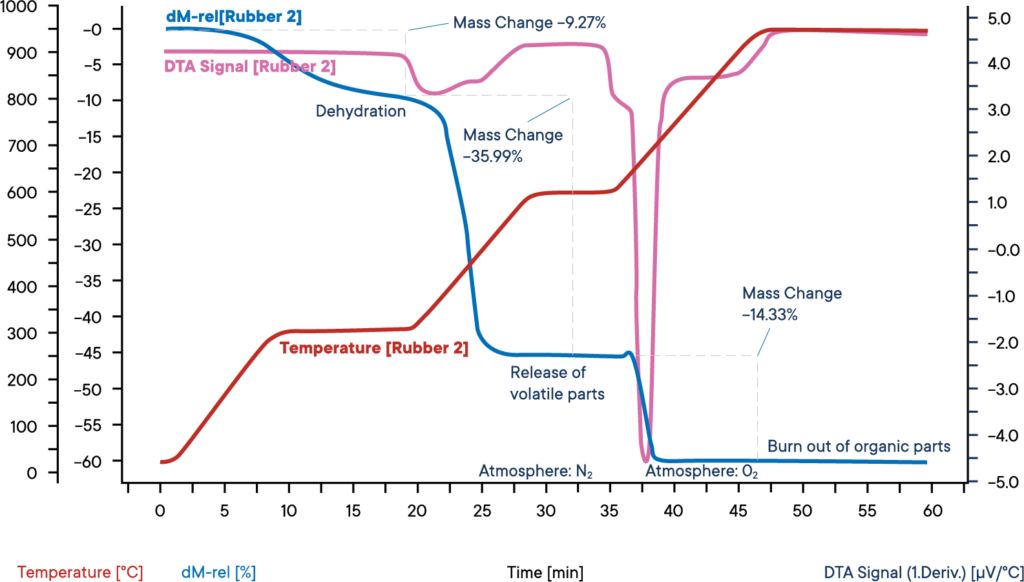
Questa misurazione di un campione di gomma industriale è stata eseguita con una termobilancia simultanea STA L81 in atmosfera di azoto.
Il campione è stato riscaldato in tre fasi, ciascuna a 30 K/min. La curva blu mostra la perdita di peso relativa. La disidratazione del campione avviene nella prima perdita di peso. Il contenuto d’acqua era del 9,3%. Il segnale DTA corrispondente (curva viola) non ha mostrato alcun effetto durante l’evaporazione dell’acqua.
Nella seconda fase di reazione, i componenti volatili vengono rilasciati per pirolisi in atmosfera di N2. La percentuale di questi componenti è del 36,0%. Il loro rilascio può essere riconosciuto da un picco di reazione esotermico sulla curva DTA.
Per la terza fase di reazione, l’atmosfera passa all’O2, che porta alla combustione del carbonio rimanente. La perdita di peso è del 14,3%. Il restante 40,4% è costituito da componenti inorganici come ceneri, scorie o cariche.
2. conversione dell’energia elettrica in energia chimica (elettrolisi, combustibili sintetici)
L’elettrolisi dell’acqua è la scissione chimica dell’acqua in ossigeno e idrogeno mediante l’applicazione di una tensione esterna. Poiché questo processo di produzione dell’idrogeno richiede molta energia, vengono utilizzati anche processi che producono idrogeno utilizzando catalizzatori o catene di reazione, come la gassificazione del carbone.
Tuttavia, l’obiettivo è quello di ottenere un’elettrolisi diretta con un’elevata produttività ed efficienza. Per migliorare l’efficienza dell’elettrolisi, è necessario ottimizzare i materiali del catodo e dell’anodo, nonché i catalizzatori e i materiali di superficie.
Poiché l’energia elettrica è difficile da immagazzinare, oggi le grandi centrali elettriche, come quelle a carbone e nucleari, producono una quantità continua di energia per coprire il carico di base, mentre le centrali elettriche più variabili, come quelle a gas, vengono utilizzate per compensare le fluttuazioni.
Poiché la generazione di energia elettrica da fonti rinnovabili è soggetta a fluttuazioni (ad esempio di notte, durante la siccità o in assenza di vento), l’energia generata deve essere immagazzinata per coprire la necessità di una domanda di energia continua e fluttuante con la generazione intermittente delle fonti di energia rinnovabili.
Inoltre, alcune applicazioni, come la la mobilità (automobili, camion, aerei a lungo raggio), richiedono grandi quantità di energia. Immagazzinare l’energia elettrica in accumulatori non è pratico, poiché gli accumulatori delle dimensioni richieste sono costosi e non sono pronti all’uso. Per queste applicazioni, è più conveniente convertire l’energia elettrica in energia chimica sotto forma di carburanti sintetici o idrogeno. Poiché i carburanti sintetici vengono prodotti anche con l’idrogeno, il passaggio più importante è la produzione di idrogeno dall’acqua tramite elettrolisi.
Esempio di applicazione: Catalizzatori – Espansione termica di fili di platino
 L’analisi termica può essere d’aiuto in questo senso, caratterizzando i materiali utilizzati in termini di stabilità chimica, conduttività termica e capacità di assorbimento, ma anche determinando l’ espansione termica per migliorare la durata e la qualità.
L’analisi termica può essere d’aiuto in questo senso, caratterizzando i materiali utilizzati in termini di stabilità chimica, conduttività termica e capacità di assorbimento, ma anche determinando l’ espansione termica per migliorare la durata e la qualità.
Il platino viene utilizzato come catalizzatore, come materiale puro o in molte leghe. Poiché l’uso in lega è il più comune, grazie ai vari vantaggi che una lega offre, il comportamento fisico e chimico cambia leggermente. L’esempio mostra la differenza di espansione termica tra il platino e il platino con il 3% di rodio.
Nell’esempio, il platino e una lega di platino sono stati misurati in un dilatometro a spinta Linseis con una velocità di riscaldamento lineare di 5 K/min. Le due curve inferiori mostrano l’espansione termica assoluta, mentre le curve superiori mostrano l’espansione relativa di un campione di platino rispetto a una lega di platino e rodio.
Anche con una leggera differenza nella composizione chimica, il comportamento di espansione mostra una deviazione di pochi μm nell’intervallo fino a 1000 °C. Quando viene utilizzato in una struttura complessa come un reattore, i valori esatti di espansione devono essere presi in considerazione per evitare danni all’unità di elettrolisi dovuti a coefficienti di espansione diversi.

Esempio di applicazione: Gestione termica – Conducibilità termica della grafite
Oltre all’espansione termica, che può causare problemi in una struttura complessa, sono molto importanti anche le proprietà termofisiche come la conducibilità termica e la resistenza specifica.
 La chiave è una corretta gestione termica. Se non ci sono grandi differenze di temperatura all’interno del reattore, non ci saranno problemi di espansione termica. Per questo motivo, è bene conoscere le proprietà di trasporto termico di tutti i materiali utilizzati.
La chiave è una corretta gestione termica. Se non ci sono grandi differenze di temperatura all’interno del reattore, non ci saranno problemi di espansione termica. Per questo motivo, è bene conoscere le proprietà di trasporto termico di tutti i materiali utilizzati.
In sintesi: L’ottimizzazione delle proprietà termofisiche aiuta a risparmiare sui costi e a migliorare la qualità. I catalizzatori nanostrutturati, ad esempio, hanno una maggiore superficie attiva e richiedono meno materie prime.
La grafite è un tipo di carbonio che si presenta come un solido grigio scuro. Ha una resistenza chimica molto elevata e viene utilizzata in molti modi diversi, ad esempio come materiale catodico, materiale da costruzione, componente di sensori e molto altro. Quando viene riscaldata, reagisce con l’ossigeno formando monossido di carbonio o anidride carbonica, ma può raggiungere temperature molto elevate se riscaldata in un ambiente inerte e privo di ossigeno; per questo motivo viene utilizzata come materiale per forni o addirittura come riscaldatore in forni ad altissima temperatura.
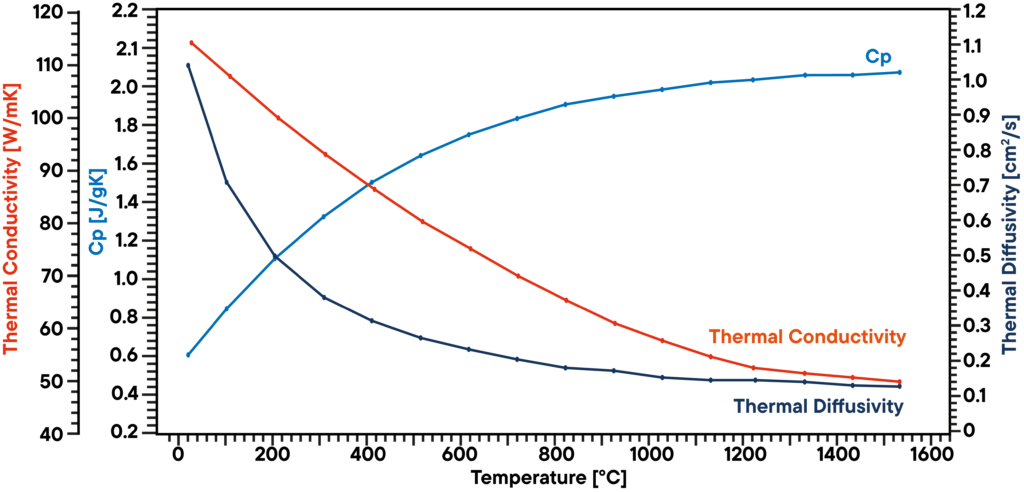
In questo esempio, un campione di grafite è stato analizzato sotto vuoto utilizzando un LFA 1000 (Laserflash Analyzer). La diffusività termica è stata misurata direttamente a diverse fasi di temperatura comprese tra RT e 1100°C. La capacità termica specifica è stata determinata con uno standard di grafite noto in una seconda posizione del campione come riferimento nella stessa misurazione.
Il prodotto della diffusività termica, del calore specifico e della densità dà la corrispondente conducibilità termica. Il risultato mostra una conducibilità termica che diminuisce linearmente, come è tipico, e una diffusività termica che presenta un plateau al di sopra dei 500°C. Il valore di Cp aumenta leggermente con la temperatura.
Esempio di applicazione: carburante sintetico – reazioni dipendenti dalla pressione a causa dell’Alta Pressione STA
Per alcune applicazioni, come gli aerei, può essere vantaggioso legare l’energia elettrica in una forma più stabile dell’idrogeno, come sono i carburanti sintetici.
I carburanti sintetici hanno il grande vantaggio di poter utilizzare le infrastrutture e le costruzioni esistenti senza alcuna modifica. L’idea è quella di utilizzare l’idrogeno verde e di produrre da esso idrocarburi sintetici. La CO2 viene catturata dall’atmosfera durante il processo di produzione, ma viene nuovamente rilasciata quando il carburante sintetico viene utilizzato (bruciato).
Il processo di produzione dei carburanti sintetici (processo Fischer-Tropsch) può essere ottimizzato con sistemi TG e TG/DSC ad alta pressione come il LINSEIS High Pressure -STA.
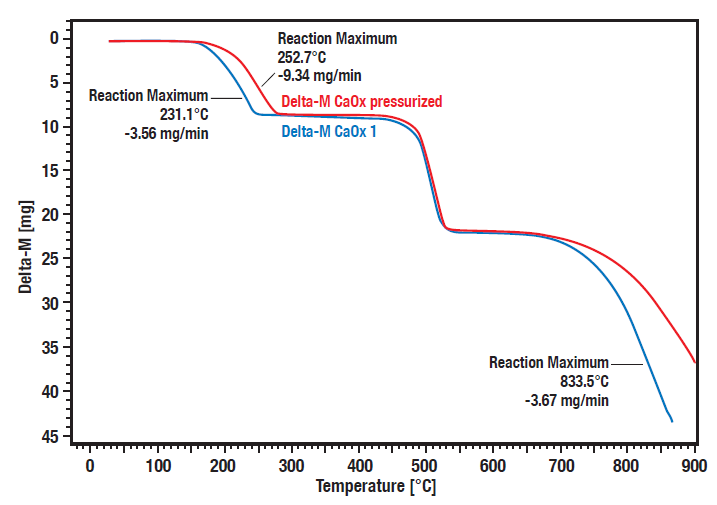
La serie Linseis STA HP consente di effettuare misurazioni in condizioni di pressione elevata e controllata. Per alcune reazioni come la decomposizione, l’adsorbimento e il desorbimento, il comportamento dei campioni e dei materiali dipende in larga misura dalle condizioni atmosferiche, in quanto in molte reazioni c’è una dipendenza dalla pressione.
Queste curve mostrano la misurazione comparativa della decomposizione dell’ossalato di calcio idrato sotto pressione (20 bar, curva rossa) rispetto alle condizioni atmosferiche (curva blu). Si può notare una chiara dipendenza dalla pressione delle fasi di decomposizione 1 (perdita di acqua) e 3 (perdita di anidride carbonica).
Le fasi di decomposizione 1 e 3 sono spostate a temperature più elevate e a pressioni maggiori. La seconda fase è la conversione irreversibile dell’ossalato organico in carbonato inorganico con il rilascio di monossido di carbonio. Poiché non è reversibile, non dipende dalla pressione.
3. stoccaggio dell’idrogeno
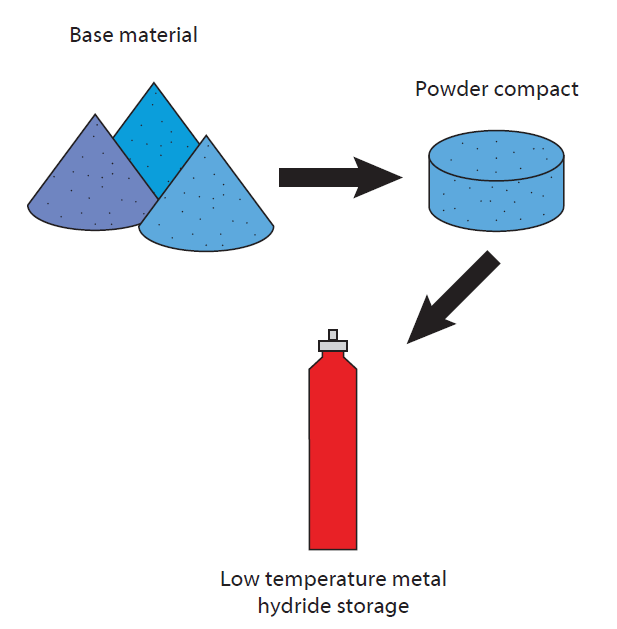
Poiché l’idrogeno è un gas molto volatile, il suo stoccaggio e trasporto rappresentano una sfida importante. Può essere immagazzinato in bombole comprimendo il gas H2, ma a causa dell’elevata pressione richiesta (esistono bombole con una pressione massima di 700 bar) e dei problemi tecnologici e di sicurezza associati (l’idrogeno si diffonde attraverso qualsiasi materiale nel tempo), si preferiscono altre tecnologie.
Ad esempio, l’idrogeno può essere immagazzinato tramite l’assorbimento su diversi materiali in cui è più o meno fissato chimicamente (strutture metallo-organiche (MOF), zeoliti, liquidi ionici, ecc.
In questo caso, l’idrogeno si lega chimicamente alla superficie del metallo formando un idruro stabile. Questo processo può essere ottimizzato aumentando l’area superficiale attraverso l’uso di materiali porosi come le zeoliti e le impalcature sintetiche con nanopori. In molti materiali, l’idrogeno può poi essere rilasciato tramite variazioni di temperatura controllate o variazioni di pressione facilmente applicabili. Il rischio di una diffusione incontrollata non esiste più.
Esempio di applicazione: Assorbimento STA ad alta pressione
Analisi termiche, in particolare analisi gravimetriche possono aiutare a determinare le esatte condizioni di assorbimento, i tassi di rilascio e di stoccaggio per ottimizzare i cicli di caricamento e rilascio.
La misurazione dell’assorbimento, che viene effettuata con metodi volumetrici, di solito non fornisce informazioni sul flusso di calore e sull’entalpia. Se il calore di assorbimento è di interesse, è necessario un secondo esperimento.
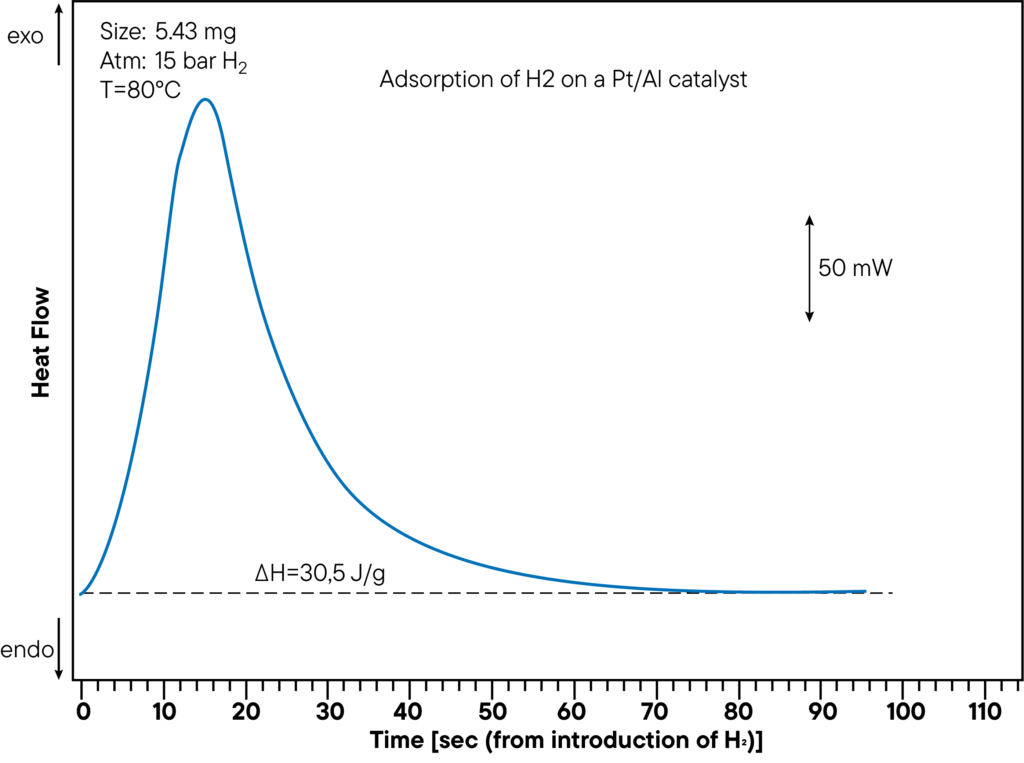
L’analizzatore di assorbimento gravimetrico ( TG-DSC ad alta pressione ), che misura sia la variazione di peso (termogravimetria TGA) che il segnale della calorimetria a scansione differenziale (DSC), offre un’alternativa molto più veloce.
In un test è possibile misurare sia la capacità di assorbimento che il calore di assorbimento. La figura mostra la sezione di misurazione DSC dell’adsorbimento dell’idrogeno su un catalizzatore Pt/Al a una pressione di 15 bar e a una temperatura di 80°C. Il calore generato è di 30,5 J/g. Il calore di assorbimento è stato determinato direttamente durante l’esperimento di assorbimento e mostra un chiaro picco. Nella curva qui sopra, è stato monitorato il tempo che intercorre tra l’iniezione di idrogeno e la reazione di assorbimento, per mostrare la velocità con cui il campione interagisce con l’atmosfera.
4. dispositivi e processi che utilizzano l’idrogeno come combustibile
Una volta che l’idrogeno è stato prodotto e immagazzinato ed è disponibile per l’uso (mobile), la sua alta densità energetica consente un’ampia varietà di applicazioni.
Gli usi più comuni sono quelli di agente riducente, carburante, gas di trasporto e per la sintesi di molecole come carboidrati, ammoniaca e molto altro. Un’applicazione frequente è la sinterizzazione dei metalli.
I pezzi metallici o contenenti ossidi metallici sono spesso prodotti compattando le polveri in cosiddetti corpi verdi. Questi corpi verdi vengono successivamente solidificati riscaldandoli a una temperatura inferiore al punto di fusione, un processo noto come sinterizzazione. Durante la sinterizzazione, le dimensioni si riducono. Di conseguenza, il processo di sinterizzazione può essere analizzato misurando le dimensioni. Di solito questo viene fatto con un dilatometro (vedi esempio di applicazione).
Per evitare l’ossidazione e ridurre il contenuto di ossidi nel prodotto finale, la sinterizzazione può avvenire in un’atmosfera contenente idrogeno o addirittura in un’atmosfera di idrogeno puro.
Grazie alla sua esperienza nella tecnologia della sicurezza dell’idrogeno, LINSEIS è in grado di fornire dilatometri da utilizzare in atmosfere di idrogeno puro. Il dilatometro può essere utilizzato per misurare la sinterizzazione o l’espansione dell’idrogeno in atmosfere riducenti. Il degasatore è accoppiato a un’unità di combustione di sicurezza e il sistema è collegato a un rilevatore di idrogeno che può spegnere il sistema e spurgarlo con gas inerte in caso di rilascio incontrollato di idrogeno.
Esempio di applicazione: Sinterizzazione H2 di polveri metalliche
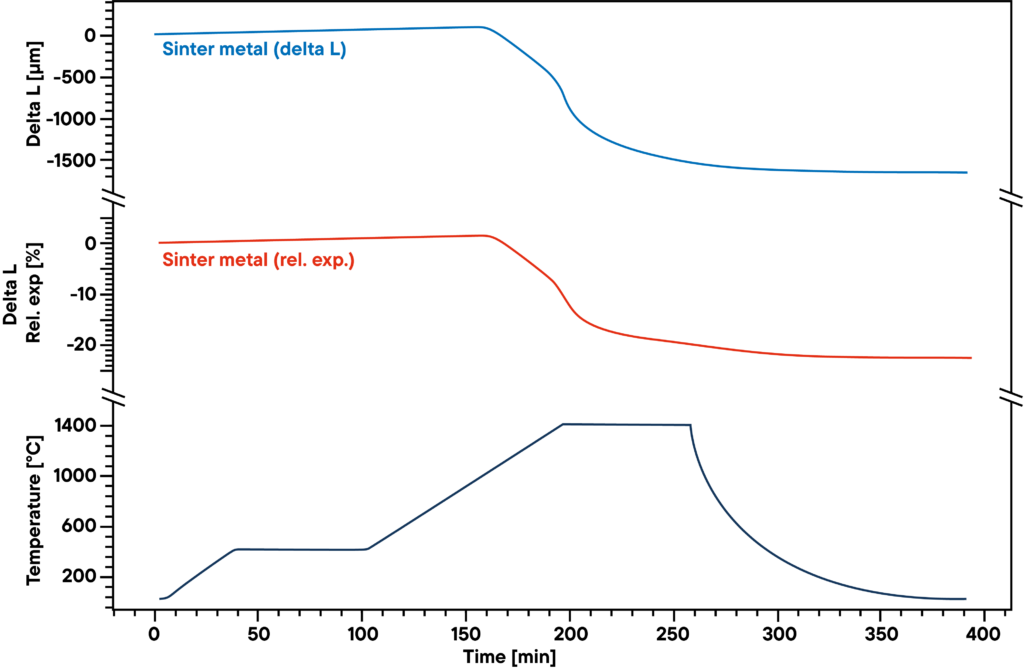
L’esempio mostra la sinterizzazione a idrogeno di corpi verdi in polvere metallica utilizzati come catalizzatori.
La misurazione mostra la curva di sinterizzazione della polvere metallica sinterizzata pressata, che è stata riscaldata in un’atmosfera di idrogeno assoluto secondo il profilo di sinterizzazione (curva inferiore).
L’idrogeno riduce l’ossigeno contenuto nel campione durante il processo di sinterizzazione e determina una maggiore densità e un minore contenuto di ossidi metallici. Pertanto, sia l’atmosfera di gas che il profilo di sinterizzazione hanno un’influenza significativa sui risultati.
La curva blu mostra l’espansione e il ritiro relativi, mentre la curva rossa mostra i valori assoluti. La fase di sinterizzazione principale si osserva nella seconda fase di riscaldamento tra 500°C e 1400°C.
5. tecnologia delle celle a combustibile
Tuttavia, le applicazioni più interessanti e più frequentemente citate per l’idrogeno sono le celle a combustibile, che possono essere utilizzate in molte situazioni diverse, dall’alimentazione di edifici con elettricità e calore all’alimentazione di automobili con un’autonomia estesa. Sono la parte fondamentale per convertire l’energia immagazzinata dall’idrogeno in elettricità.
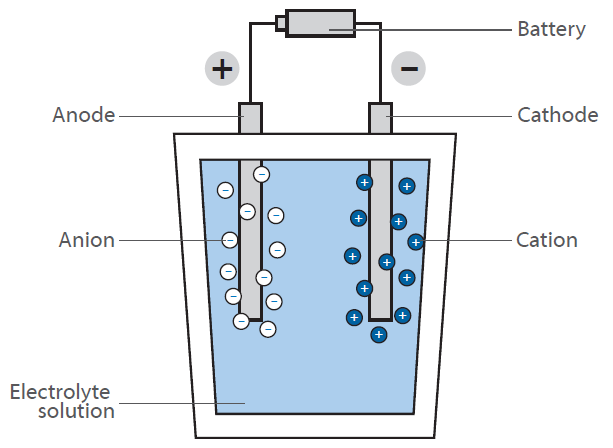
In una cella a combustibile, l’idrogeno reagisce con l’aria per formare acqua. Questa reazione non viene sfruttata direttamente dalla combustione con il rilascio di calore, ma in una cella a combustibile per generare energia elettrica: il diagramma mostra una rappresentazione schematica di una cella a combustibile a idrogeno.
Il suo compito è quello di generare energia elettrica “su richiesta” attraverso la reazione di idrogeno e ossigeno. A differenza della classica reazione diretta, in cui si forma l’acqua con un grande rilascio di energia sotto forma di calore (immagina una miscela di gas idrogeno e ossigeno che viene accesa), una cella a combustibile ha due camere in cui si trovano i due composti.
Al centro di queste camere c’è una membrana che permette la diffusione dell’idrogeno, ma non di altre molecole. Sulla superficie della membrana sul lato della camera dell’ossigeno, avviene la reazione tra idrogeno e ossigeno, producendo acqua che viene portata fuori dalla cellula. Questo porta a una diminuzione della concentrazione di idrogeno sulla membrana e fa sì che più molecole di idrogeno migrino verso la membrana.
La diffusione dell’idrogeno nella camera contenente ossigeno genera una tensione elettrica sulla membrana. Questa energia viene rilasciata al posto del calore e può essere utilizzata per far funzionare un motore.
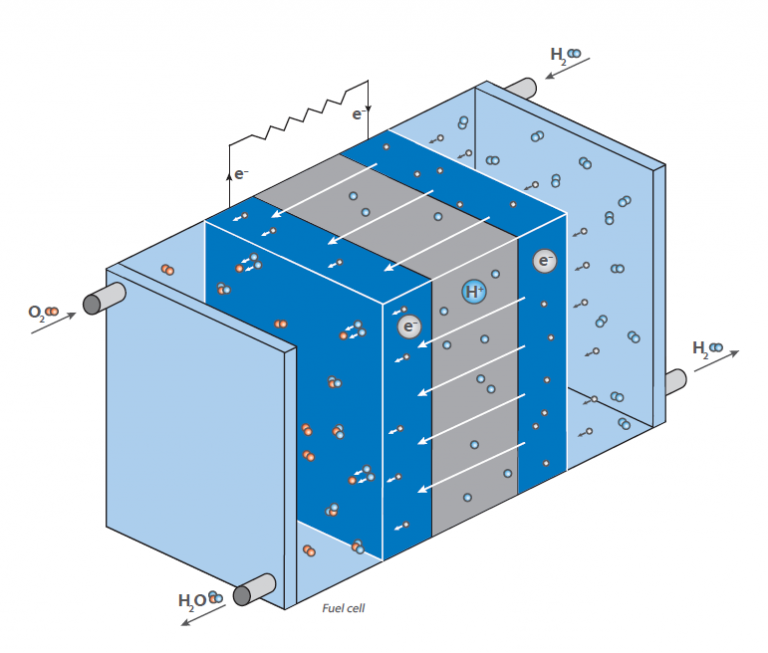
Poiché la concentrazione di idrogeno nella camera dell’idrogeno può essere regolata, la velocità di diffusione sulla membrana può essere facilmente controllata, proprio come in un motore a benzina. L’idrogeno può quindi essere considerato come un “carburante”. La membrana è ricoperta da un elettrodo composto da metalli preziosi. Questi metalli agiscono come catalizzatori e influenzano le condizioni di lavoro della cella a combustibile (temperatura, tensione, ecc.).
Poiché le celle a combustibile alimentate a idrogeno possono funzionare a temperature elevate, fino a 1000°C, e le saldature utilizzate per assemblarle devono essere stabili dal punto di vista termico, chimico e meccanico, è qui che entra in gioco l’analisi termica. Le condizioni di funzionamento delle celle a combustibile dipendono dai materiali utilizzati, che possono agire come catalizzatori.
Ad esempio, tutte le tecniche utilizzate per caratterizzare i catalizzatori hanno applicazioni nella tecnologia delle celle a idrogeno/carburante. Di conseguenza, è necessaria una grande conoscenza della scienza dei materiali e molte tecniche analitiche aiutano ad analizzare i materiali. In questo caso, ci concentreremo sulle tecniche di analisi termica.
Alcune applicazioni di stoccaggio dell’idrogeno funzionano ad alta pressione, a volte superiore a 100 bar, per cui sono utili analizzatori pressurizzati. Inoltre, tutte le tecniche di analisi richiedono precauzioni a causa dell’elevata reattività dell’idrogeno rispetto all’ossigeno/aria. Di conseguenza, tutti gli analizzatori devono essere dotati di funzioni di sicurezza per evitare il rischio di esplosioni.
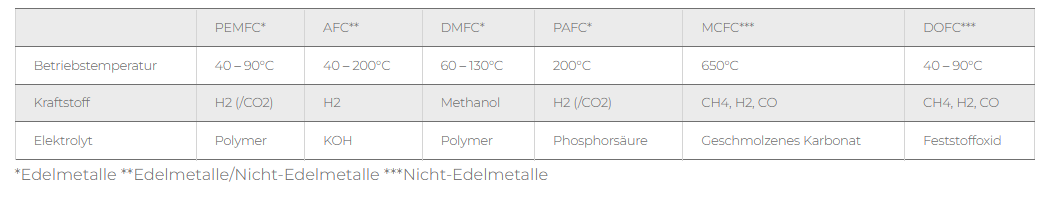
Esempio di applicazione: Rilascio di idrogeno dallo stoccaggio in superficie
Il seguente esempio di applicazione mostra l’utilizzo di dispositivi per l’analisi termica e la scienza dei materiali nel campo delle celle a combustibile.
Lo stoccaggio dell’idrogeno può avvenire sotto forma di adsorbimento superficiale, adsorbimento dei pori o assorbimento chimico. Per la maggior parte dei metalli, l’adsorbimento superficiale è la via più promettente perché è facile da realizzare e il rilascio di idrogeno può essere controllato molto bene. Per questo motivo si stanno studiando molti metalli con un’elevata area superficiale specifica.
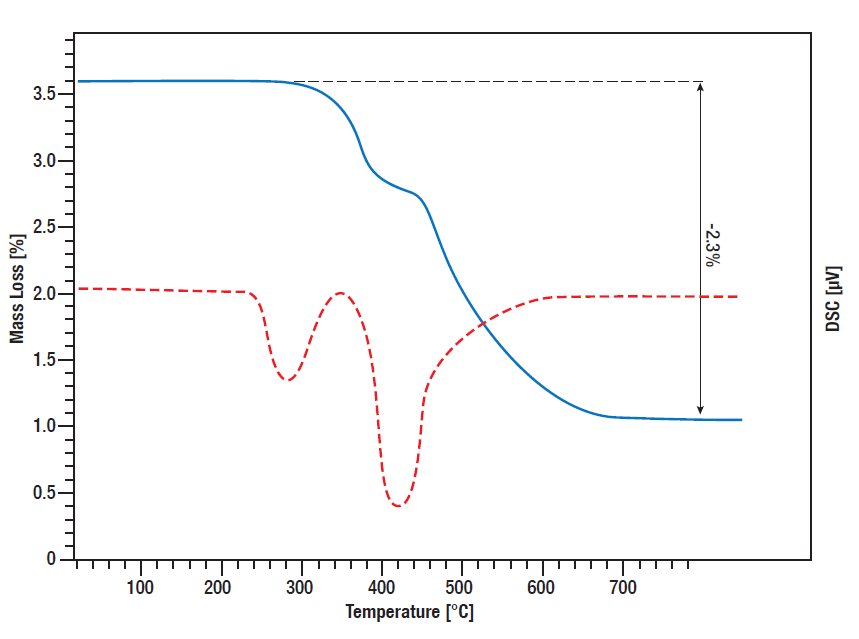
L’idruro di titanio è una fonte di idrogeno spesso utilizzata per il rilascio controllato di idrogeno in varie reazioni. Da un lato, può essere utilizzato come catalizzatore nella chimica dei liquidi in situ come fonte di idrogeno, dall’altro può essere utilizzato nelle batterie o nelle celle a combustibile per il rilascio controllato di idrogeno, ad esempio.
Per avere un’idea della quantità di idrogeno rilasciata a quale temperatura, è importante conoscere il comportamento di decomposizione in funzione della temperatura e la quantità di calore rilasciata, che può essere monitorata tramite l’analisi termica simultanea (STA).
In questa misurazione STA è stato monitorato il rilascio di idrogeno da parte dell’idruro di titanio. I segnali TG e DSC sono stati misurati da temperatura ambiente a 800°C mentre il campione veniva riscaldato linearmente in atmosfera di argon a 10 K/min. Tra i 300°C e i 600°C si verifica una perdita di massa in due fasi pari al 2,3%, il che significa che l’intera quantità di idrogeno legato viene rilasciata in questo processo. La curva DSC mostra i corrispondenti picchi di desorbimento (curva rossa).
Sicurezza nelle misurazioni dell’idrogeno
L’idrogeno ha un’elevata affinità per gli agenti ossidanti e le superfici metalliche, oltre che per l’ossigeno. La formazione di acqua dagli elementi (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) è una reazione esotermica, motivo per cui l’idrogeno è considerato un potente accumulatore di energia.
Le miscele idrogeno-aria con un contenuto di idrogeno superiore al 4% circa sono potenzialmente esplosive. L’energia di attivazione (senza catalizzatore) è elevata, ma in presenza di una fiamma, di una scintilla o di una temperatura elevata queste miscele possono bruciare o esplodere. Pertanto, sono necessarie alcune precauzioni di sicurezza per qualsiasi analisi termica con concentrazioni di idrogeno superiori al 4% nell’aria.
Tutti gli analizzatori termici LINSEIS per applicazioni con idrogeno possono essere dotati delle seguenti caratteristiche di sicurezza:

- Rilevatori di idrogeno: rilevano eventuali perdite nei tubi del gas. Questi rilevatori sono posizionati vicino all’apparecchio e rilevano qualsiasi perdita o rilascio accidentale di idrogeno.
- Spurgo con gas inerte: Se viene rilevata una perdita e l’alimentazione di idrogeno viene interrotta, l’idrogeno residuo nell’analizzatore viene spurgato con gas inerte.
- Valvole di sicurezza:
Non appena viene rilevata una perdita di idrogeno, le valvole di sicurezza si attivano e interrompono la fornitura di idrogeno all’analizzatore termico.
- Unità di scarico per il degassamento:
Tutti i sistemi a idrogeno Linseis sono dotati di un’unità di scarico per il degassamento. I gas in uscita (gas campione, gas di lavaggio e prodotti di decomposizione) passano attraverso la fiamma costantemente accesa per garantire che non vengano rilasciati nell’ambiente gas infiammabili che possono raggiungere una concentrazione critica nel laboratorio. L’unità della fiamma è riscaldata elettricamente ed è dotata di un meccanismo di sicurezza che impedisce alla fiamma di retrocedere nelle linee del gas.
