Entalpia
Entalpia – zmienna mierzona w analizie termicznej
Co to jest entalpia?
Entalpia reakcji to zmiana entalpii próbki podczas reakcji chemicznej. Reakcje, w których energia jest uwalniana w postaci ciepła, są określane jako egzotermiczne. Reakcje, w których energia musi zostać dostarczona, nazywane są endotermicznymi.
Entalpie topnienia są prostym przykładem procesów endotermicznych, ponieważ zwykle konieczne jest zastosowanie ciepła do układu w celu rozbicia jego stałej struktury krystalicznej i przekształcenia go w fazę ciekłą z cząsteczkami, które mogą się swobodnie poruszać względem siebie. Przykładem reakcji egzotermicznej jest prosty proces spalania, w którym substancja reaguje z tlenem, uwalniając energię.
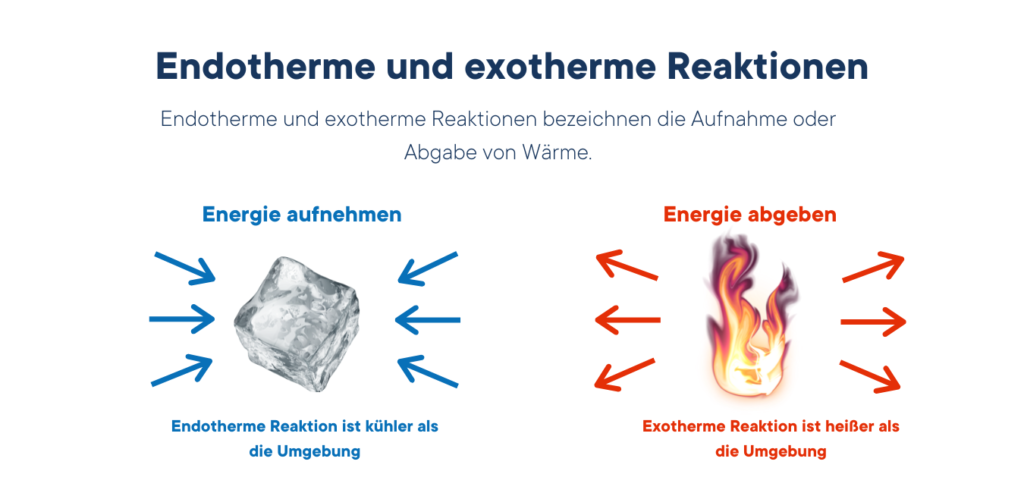
Różnica między reakcjami endotermicznymi i egzotermicznymi:
Endotermiczny:
- Energia jest zużywana (ciepło jest pochłaniane)
- Energia zużyta lub wymagana do reakcji
- Wzrost entalpii wewnętrznej
Przykładami procesów endotermicznych są
- Rozpuszczanie soli w rozpuszczalnikach
- Rozszczepianie alkanów
- Płyny odparowujące
- Topniejące ciała stałe
Egzotermiczny:
- Uwalniana jest energia (uwalniane jest ciepło)
- Reakcja jest spontaniczna lub wywołana
- Spadek entalpii wewnętrznej
Przykłady procesów egzotermicznych:
- Reakcja termitowa
- Neutralizacja (np. mieszanie kwasu i zasady w celu utworzenia soli i wody)
- Większość reakcji polimeryzacji
- Spalanie
- Oddychanie
- Korozja metali (reakcja utleniania)
- Większość procesów krystalizacji
