Descrizione del
Al punto
Differenza tra vapore acqueo e umidità relativa nell’analisi termica
Quando l’acqua viene riscaldata fino al punto di ebollizione o oltre, cambia il suo stato fisico da liquido a gassoso. Si presenta quindi come vapore (d’acqua). Se questo vapore viene introdotto in una camera di reazione o in un dispositivo, si parla di applicazione del vapore acqueo.
Al contrario, ogni gas può trasportare e contenere una certa quantità di acqua a una certa temperatura. Questo fenomeno è noto come umidità. Utilizzando l’aria come esempio, si può determinare che anche al di sotto del punto di ebollizione dell’acqua, una certa quantità d’acqua è sempre contenuta nell’aria, che è nota come grado di umidità o umidità relativa è definita umidità relativa.
A differenza dell’umidità relativa, l’acqua al di sopra del punto di ebollizione dipendente dalla pressione, che è di 100°C al livello del mare, è presente solo in fase gassosa, sotto forma di vapore acqueo. Miscelando il vapore acqueo, che viene generato in un generatore di vapore acqueo, con un gas di trasporto come aria, azoto o elio, la concentrazione (in vol%, wt% o ppm) del vapore acqueo nel gas campione può essere regolata in modo variabile nei nostri analizzatori.
Inoltre, l’atmosfera di gas nel dispositivo può essere statica o dinamica, a seconda dell’applicazione. I test tipici per le atmosfere dinamiche di vapore acqueo prevedono il riscaldamento isotermico di un campione e il successivo dosaggio di una concentrazione definita di vapore acqueo per avviare una reazione. Ciò può comportare, ad esempio, misure di adsorbimento, desorbimento, riduzione, ossidazione o conversione.
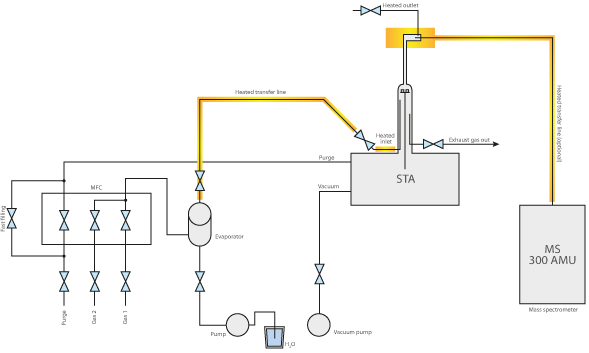
Nell’analisi termica, i generatori di vapore acqueo vengono solitamente utilizzati in combinazione con le termobilance come la TGA e lo STA (nel campo dell’alta pressione) e dilatometri vengono utilizzati.
Misure dipendenti dalla pressione in un'atmosfera di vapore acqueo
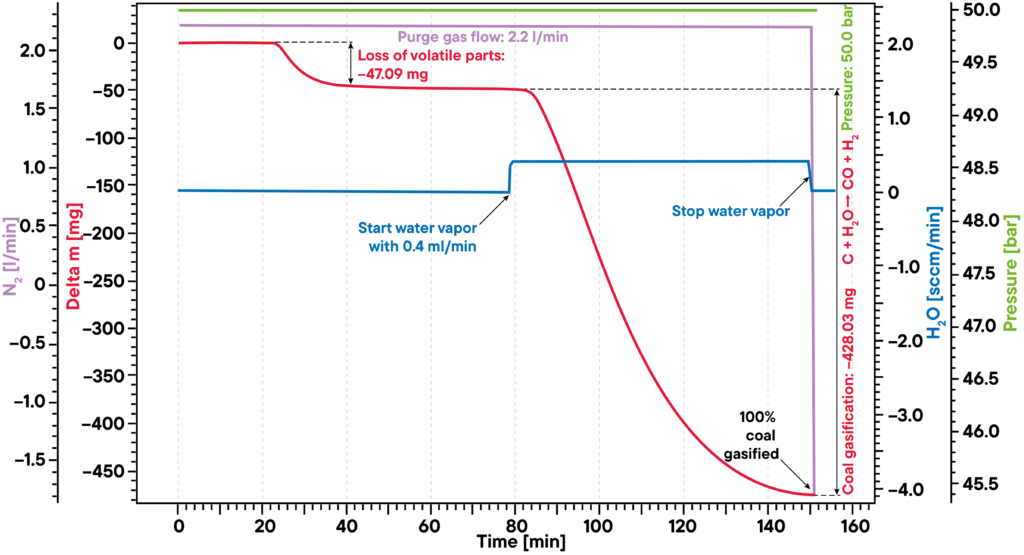
Oltre alla concentrazione e alla temperatura, è possibile controllare anche il livello di pressione dell’atmosfera, che ha una grande influenza sull’esperimento. Un livello di pressione elevato è particolarmente interessante per modificare le condizioni di equilibrio delle reazioni, ad esempio nella gassificazione del carbone o della biomassa, che possono essere studiate con i nostri analizzatori STA ad alta pressione.
Tuttavia, con l’aumento del livello di pressione, è necessario tenere conto di nuove condizioni al contorno. Ad esempio, il punto di ebollizione si sposta verso temperature più elevate all’aumentare del livello di pressione, fino a raggiungere il cosiddetto punto critico.
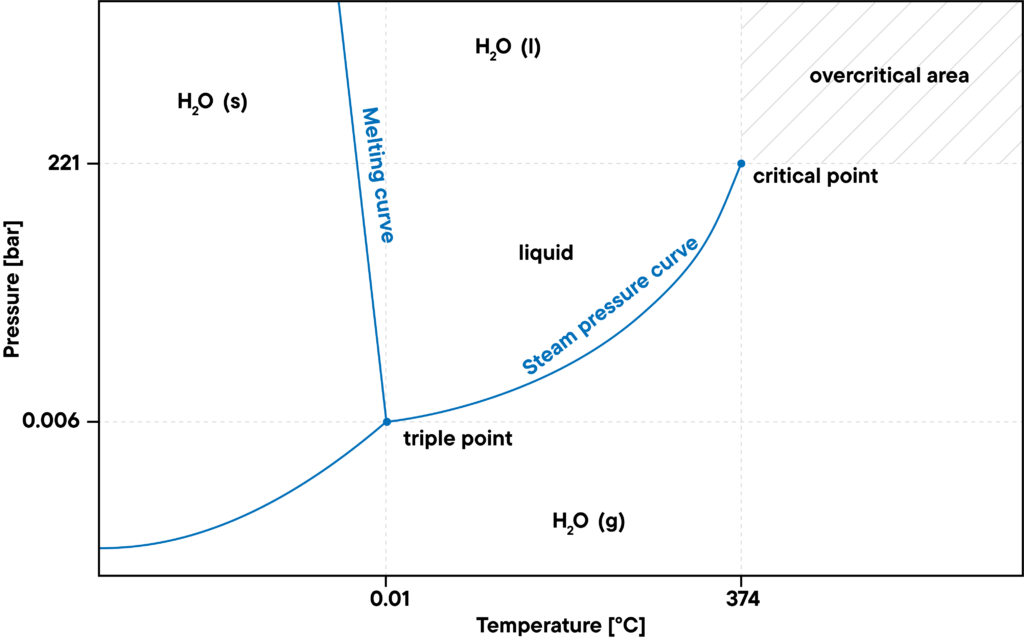
D’altra parte, il livello massimo di pressione dell’acqua gassosa è definito dalla curva della pressione di saturazione del vapore. Se la pressione diventa troppo alta, l’acqua si condensa. A temperature o pressioni più elevate, al di sopra del punto critico, la densità dell’acqua liquida è pari a quella dell’acqua gassosa, per cui non può più condensare. Si parla di stato supercritico, ad esempio di vapore acqueo surriscaldato.
Domande? Chiamaci!
+49 (0) 9287/880 0
giovedì dalle 8.00 alle 16.00
e venerdì dalle 8.00 alle 12.00.
Siamo qui per te!
Applicazioni
Ben informato


