Oksidasyon
İçindekiler
Oksidasyon, bir molekülden, atomdan veya iyondan elektronlar kaybolduğunda meydana gelen kimyasal bir süreçtir. Kalorimetri bağlamında, oksidasyon genellikle ısı şeklinde enerji açığa çıkarmak için maddelerin yanmasını veya ayrışmasını içeren bir termal analiz olarak analiz edilir.
Diferansiyel Tarama Kalorimetrisi (DSC) ısıtma veya soğutma sırasında bir numunenin oksidasyonu ile ilişkili ısı akışını ölçtüğü için bu süreci karakterize etmek için kullanılabilecek bir tekniktir. DSC (Diferansiyel Taramalı Kalorimetri) ile oksidasyon ölçümünün arkasındaki prensip, oksidasyon reaksiyonlarının ekzotermik doğasına dayanmaktadır.
DSC’de oksidasyon izotermal veya izotermal olmayan şekilde incelenebilir. İzotermal oksidasyon çalışmaları için, DSC numune potasının sıcaklığı sabit bir sıcaklığa ayarlanır ve numunenin oksidasyonu zaman içinde izlenir.
Oksidasyonun başlangıcı tipik olarak DSC eğrisinde ekzotermik bir pikin ortaya çıkmasıyla gösterilir; bu pik, numune oksitlenirken ısının açığa çıkmasına karşılık gelir. Ekzotermik pikin oluştuğu zamana oksidasyon indüksiyon zamanı (OIT) denir ve numunenin oksidasyona karşı direncinin bir ölçüsüdür. Yöntem Şekil 1’de gösterilmiştir.
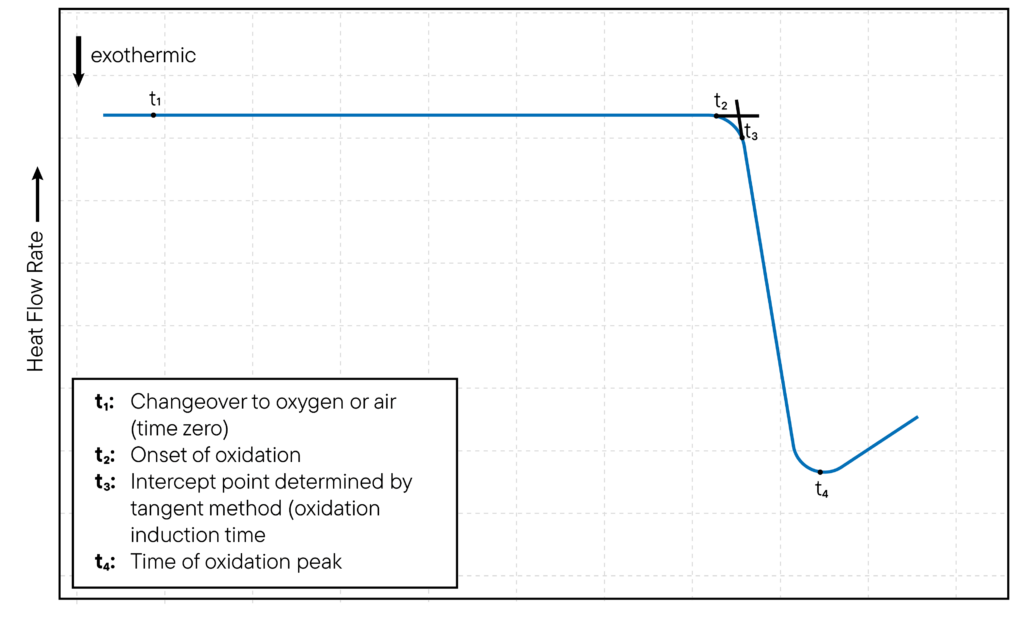
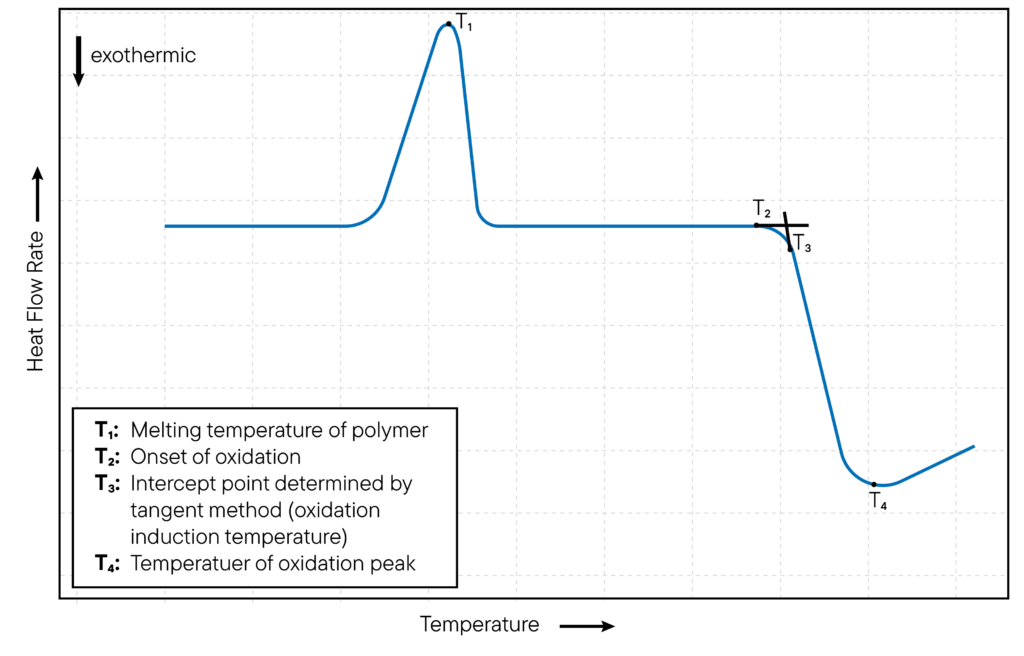
İzotermal olmayan oksidasyon çalışmalarında, DSC hücresinin sıcaklığı sabit bir oranda artırılır ve numunenin oksidasyonu sıcaklığın bir fonksiyonu olarak izlenir.
DSC cihazı, bir numune oksitlendiğinde ve ısı açığa çıktığında DSC eğrisinde ekzotermik bir pik tespit eder. Pikin oluştuğu sıcaklık oksidasyon başlangıç sıcaklığı (OOT) olarak adlandırılır.
Yöntem Şekil 2’de gösterilmektedir. OOT, numunenin termal kararlılığının bir ölçüsüdür ve malzemelerin oksidatif kararlılığını değerlendirmek için kullanılır.
Özetlemek gerekirse, farklı sıcaklıklarda oksidasyon indüksiyon süresi (OIT) veya oksidasyon başlangıç sıcaklığı (OOT) ölçülerek, oksidasyon için aktivasyon enerjisi belirlenebilir ve bu da numunenin termal kararlılığı hakkında bilgi sağlar.
DSC, antioksidanların ve diğer katkı maddelerinin numunelerin oksidatif stabilitesi üzerindeki etkilerini değerlendirmek için de kullanılabilir, bu da kalite ve raf ömrü açısından önemlidir.
DSC, oksidasyon sürecini başlatmak için gereken enerjinin bir ölçüsü olan oksidasyon için aktivasyon enerjisini belirlemek için de kullanılabilir.
Aktivasyon enerjisi, bir kimyasal reaksiyonun hızını gerçekleştiği sıcaklıkla ilişkilendiren Arrhenius denklemi kullanılarak hesaplanabilir. Oksidasyon için aktivasyon enerjisi, farklı sıcaklıklarda oksidasyon indüksiyon süresi (OIT) veya oksidasyon başlangıç sıcaklığı (OOT) ölçülerek ve veriler bir Arrhenius diyagramı üzerinde çizilerek belirlenebilir.
Ortaya çıkan çizginin eğimi, oksidasyon için aktivasyon enerjisini hesaplamak için kullanılır. DSC eğrisi, başlangıç sıcaklığı, pik sıcaklığı ve oksidasyon ısısı gibi oksidasyonla ilgili çeşitli parametreleri belirlemek için analiz edilebilir.
Hem OIT hem de OOT, malzemelerin oksidasyon kararlılığını değerlendirmek için önemli parametrelerdir ve özellikle polimerlerde antioksidanların etkinliği karşılaştırılabilir.
Daha uzun OIT veya daha yüksek OOT, daha yüksek oksidatif stabilite ve bozunmaya karşı direnci gösterir. Oksidasyon için DSC ölçümlerinin doğruluğunu etkileyebilecek faktörler arasında numune hazırlama, enstrümantasyon ve ısıtma hızı ve atmosfer gibi deneysel koşullar yer alır.
Termal analiz, bir metal oksidin oluştuğu oksijen içeren bir atmosferde metallerin oksidasyonunu incelemek için kullanılabilir ve TGA gibi teknikler kullanılarak sıcaklık veya zamana bağlı kütle artışı gözlemlenebilir.
Oksidasyon sırasında ayrışma
Referanslar:
- Stephen M. Hsua ve Chun-I Chenb, Dizel motor performansını tahmin etmek için bir kimyasal kinetik modeli, Bölüm II. Bench-test prosedürleri: Tribology Letters, Cilt 14, No. 2, Şubat 2003.
- B. Wunderlich, Polimerik Malzemelerin Termal Analizi. Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg, 2005.
- G. W. Ehrenstein, G. Riedel ve P. Trawiel, Plastiklerin termal analizi: Teori ve uygulama. Münih: Hanser, 2004.
- Plastikler – Diferansiyel Tarama Kalorimetrisi (DSC), ISO 11357-6, 2008.
- Mahbuba Islam, Anna Kaczmarek ve Jolanta Tomaszewska-Gras, Raf ömrü boyunca soğuk preslenmiş yağların oksidasyon durumunu değerlendirmek için bir araç olarak diferansiyel tarama kalorimetrisi: Gıda Ölçüm ve Karakterizasyon Dergisi (2023) 17:6639-6651.