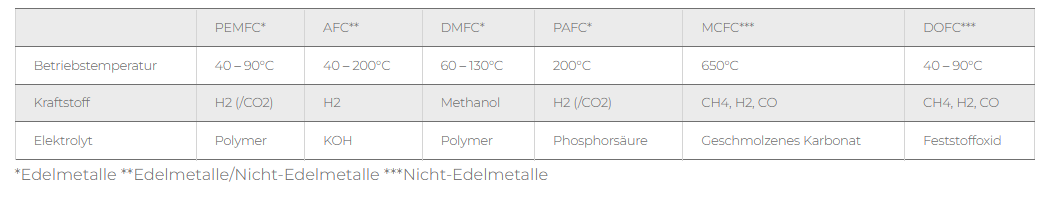
Technologia wodorowa i analiza termiczna
Spis treści
Zielona energia – Cykl wodorowy – Gospodarka wodorowa
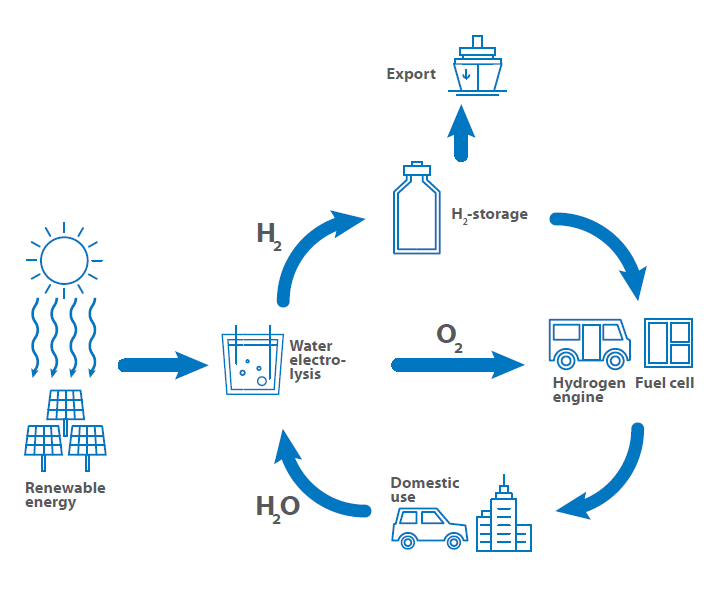
Istotnym kluczem do zielonej energii i mobilności jest wykorzystanie wodoru jako paliwa, do magazynowania energii oraz jako narzędzie w procesach transferu energii. Z tego powodu opracowano tak zwany cykl wodorowy, który pokazuje wykorzystanie wodoru od produkcji poprzez magazynowanie i eksport do wykorzystania jako paliwo z powrotem do produkcji.
Ponieważ istnieje wiele ścieżek dla każdego kroku w tym cyklu, niektóre koncepcje badawcze zostały stworzone w celu wypełnienia luk i uzyskania dostępu do technik, które są niezbędne i nie zostały jeszcze w pełni opracowane. The Organizacja Badawcza Fraunhofera opracowała i opublikowała mapę drogową wodoru dla Niemiec, w której przedstawiono wszystkie obszary i tematy badawcze.
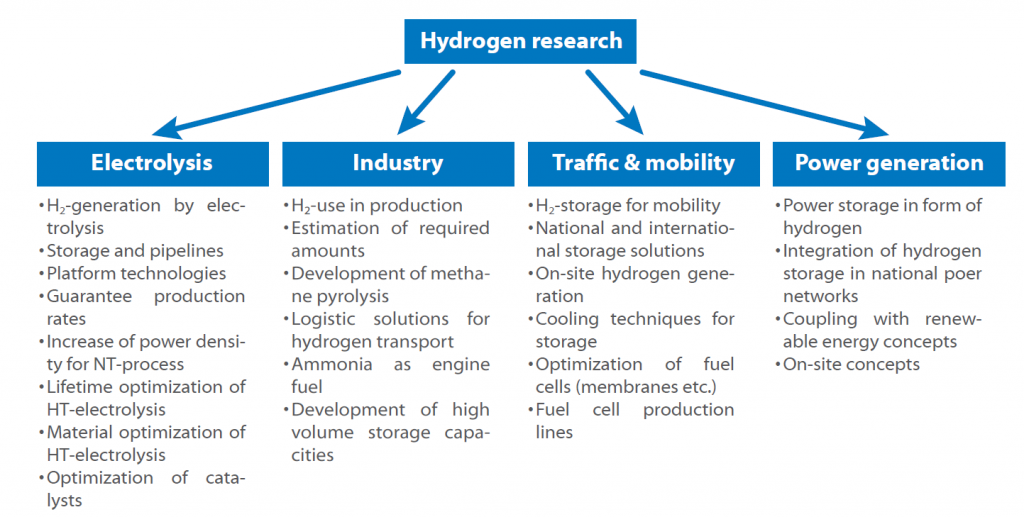
Mapa drogowa pokazuje możliwe zastosowania wodoru w najbliższej przyszłości. Kluczową kwestią jest zawsze magazynowanie i produkcja, ponieważ każdy sektor jest dotknięty kwestią bezpiecznego i wydajnego przechowywania wodoru.
Kolejnym pytaniem, na które należy odpowiedzieć, jest to , czy bardziej obiecująca jest scentralizowana czy zdecentralizowana produkcja wodoru i czy powinien on być wykorzystywany jako paliwo bezpośrednio, czy w postaci amoniaku lub podobnych substancji.
1. cykl wodorowy – odnawialne źródła energii
Cykl wodorowy rozpoczyna się od produkcji wodoru przez ekologiczne elektrownie. Do najważniejszych źródeł produkcji energii odnawialnej należą elektrownie wodne, turbiny wiatrowe, systemy fotowoltaiczne, elektrownie geotermalne i elektrownie na biomasę, których celem jest wytwarzanie energii w wystarczających ilościach bez emisji CO2 i bez odpadów jądrowych.
Analiza termiczna i materiałoznawstwo są obecne we wszystkich obszarach:
- Z badań nad materiałami kompozytowymi, takimi jak te stosowane w łopatach turbin wiatrowych
- do optymalizacji materiałów półprzewodnikowych w ogniwach fotowoltaicznych
- do optymalizacji bezpośredniej produkcji wodoru z biomasy.

Przykład zastosowania: Rozszerzalność cieplna lekkich materiałów
Dobrym przykładem zastosowania analizy termicznej w dziedzinie odnawialnych źródeł energii jest zachowanie rozszerzalności cieplnej rozszerzalność cieplna lekkich materiałów, takich jak materiały kompozytowe na łopaty turbin wiatrowych:
Materiały kompozytowe są wykorzystywane w lekkich konstrukcjach lub jako specjalne materiały konstrukcyjne do wielu celów.
Na przykład łopaty turbin wiatrowych są wykonane z lekkich stopów aluminium lub lekkich polimerów.
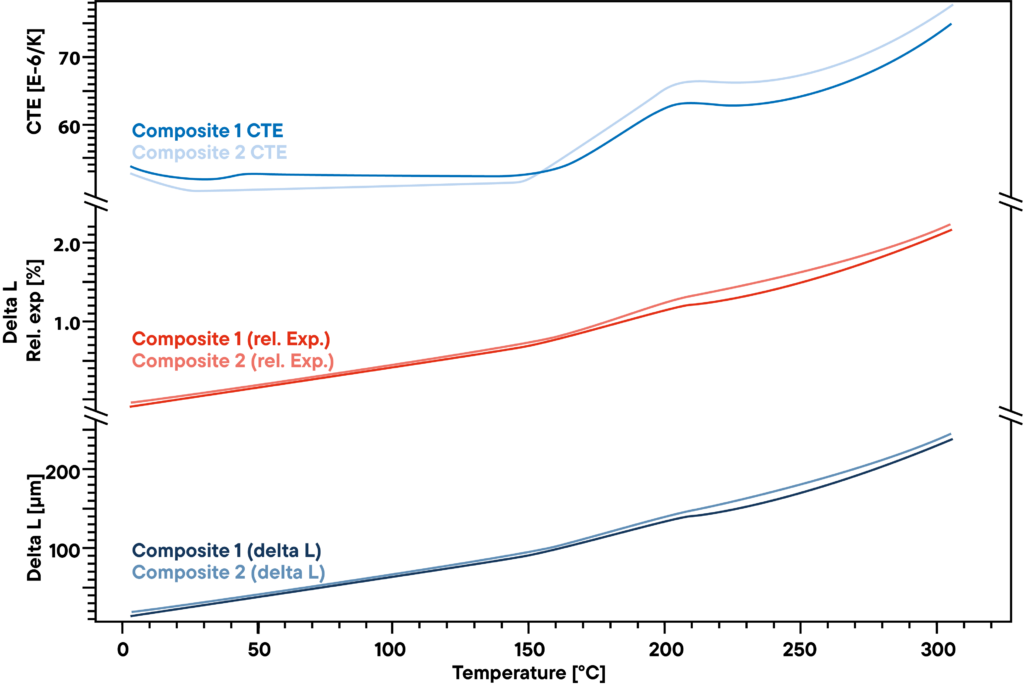
Pomiar pokazuje niewielką różnicę w dwóch kompozytach polimerowych stosowanych do sztywnych, ale lekkich konstrukcji, takich jak łopaty turbin wiatrowych. Bezwzględna delta L, która została zmierzona za pomocą dylatometru Linseisa przy stałym tempie ogrzewania 5 K/min (dolna krzywa), nie wykazuje większych różnic między dwiema analizowanymi próbkami. Względne rozszerzenie (czerwone krzywe) jest również bardzo podobne.
Istnieje jednak niewielka różnica, która staje się widoczna, gdy spojrzymy na współczynnik CTE. Przed punktem transformacji w temperaturze około 200°C występuje niewielki efekt, który można zaobserwować tylko w jednej z dwóch próbek i wskazuje na kolejną niewielką transformację lub zmianę fazową, której nie wykazuje drugi materiał.
Przykład zastosowania: DEA – analiza dielektryczna / monitorowanie utwardzania
Dla opłacalnej i wysokiej jakości produkcji materiałów kompozytowych niezwykle ważna jest znajomość zarówno dokładnego czasu, jak i profilu temperaturowego wymaganego do ukończenia określonej części.
Jeśli parametry te zostaną dobrane nieprawidłowo, albo nie będzie można osiągnąć odpowiedniej jakości, albo zmarnowane zostaną pieniądze. Proces utwardzania można monitorować za pomocą DEA – analizy dielektrycznej – jeśli czas oczekiwania jest zbyt długi.
Utwardzanie większości polimerów można obserwować za pomocą czujników DEA, które są wprowadzane do nieutwardzonego materiału.
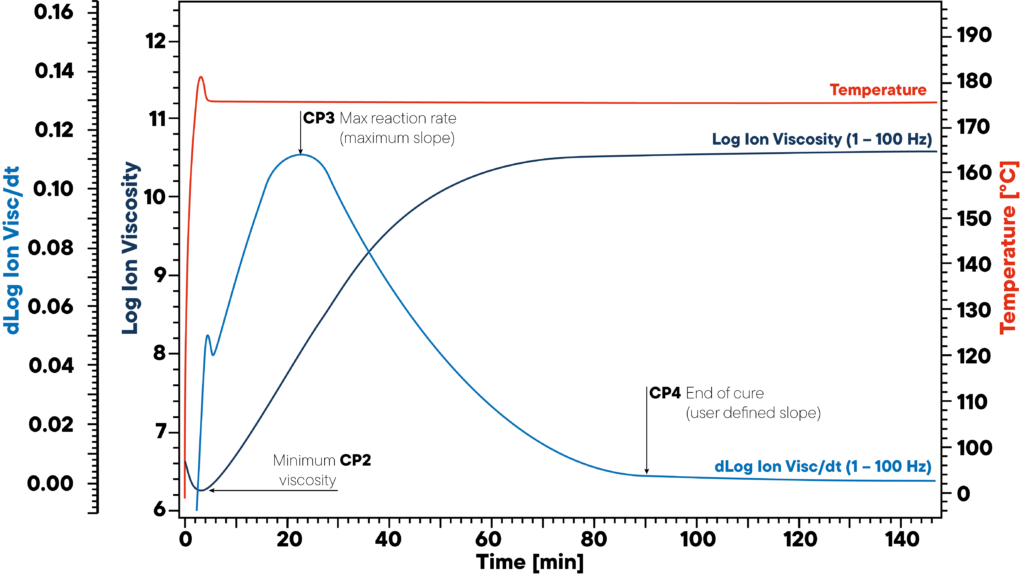
W tym przykładzie żywica jest podgrzewana izotermicznie do temperatury 180 °C i dołączany jest czujnik DEA. Czerwona krzywa pokazuje temperaturę izotermiczną próbki i czujnika. Monitorowana jest lepkość jonowa i nachylenie lepkości jonowej.
Trzy istotne punkty CP2, CP3 i CP4 oznaczają początek (minimalna lepkość), maksymalną prędkość reakcji (maksymalne nachylenie) i koniec utwardzania. Informacje te mają kluczowe znaczenie dla prawidłowego utwardzania polimerów, ponieważ nieutwardzone materiały mogą prowadzić do poważnych problemów z jakością.
Przykład zastosowania: Jakość i zachowanie surowców, np. biomasy.
Kolejną ważną kwestią dla produkcji wodoru jest jakość i zachowanie surowców, np. biomasy wykorzystywanej do wytwarzania energii elektrycznej i wodoru.
 Pytanie brzmi, ile wodoru można uzyskać z różnych surowców podczas zgazowania, ile energii jest do tego potrzebne i jak wygląda ogólny wynik. Można to monitorować za pomocą termograwimetrii ciśnieniowej oraz połączonej termograwimetrii i kalorymetrii (STA), jak pokazano w poniższym przykładzie zastosowania.
Pytanie brzmi, ile wodoru można uzyskać z różnych surowców podczas zgazowania, ile energii jest do tego potrzebne i jak wygląda ogólny wynik. Można to monitorować za pomocą termograwimetrii ciśnieniowej oraz połączonej termograwimetrii i kalorymetrii (STA), jak pokazano w poniższym przykładzie zastosowania.
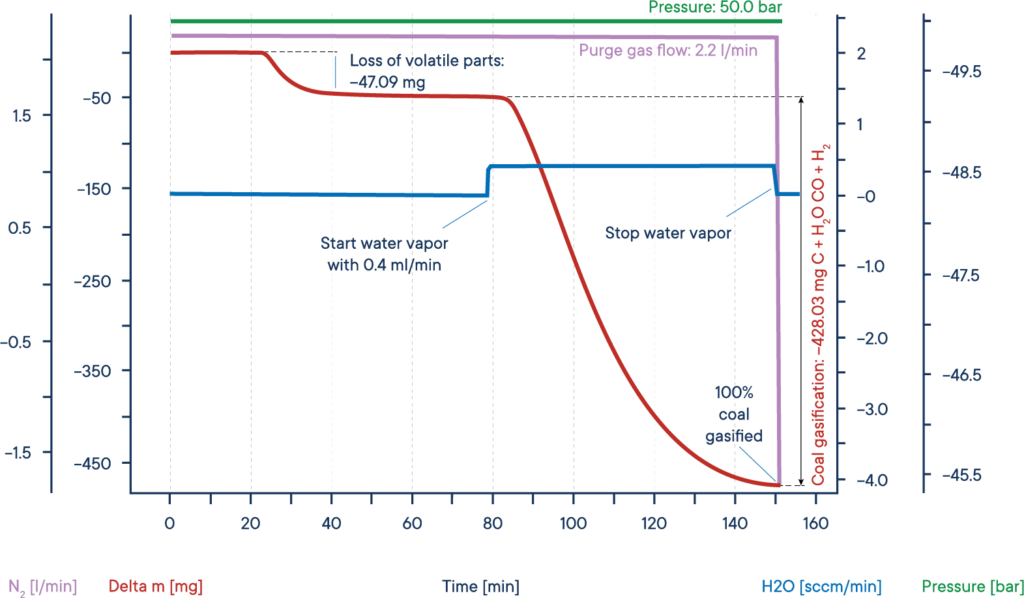
Typowym zastosowaniem wysokociśnieniowych pomiarów TGA jest badanie tzw. gazyfikacji lub hydrogazyfikacji węgla. Proces ten, w którym węgiel jest podgrzewany w atmosferze pary wodnej, jest wykorzystywany w procesach katalitycznych, na przykład do usuwania tlenku węgla z gazów spalinowych, a zwłaszcza do ekstrakcji cennych związków organicznych z zasobów takich jak węgiel drzewny lub biomasa.
Podany przykład przedstawia typowy test zgazowania suchej biomasy. Próbka biomasy została podgrzana do izotermicznego plateau w atmosferze azotu pod ciśnieniem 50 barów ( Wysokociśnieniowe TGA – termobalans ).
Sygnał masy pokazuje utratę substancji lotnych między 20 a 40 minutą. Po dodaniu pary wodnej biomasa została zgazowana i prawie całkowicie zużyta po 150 minutach, w wyniku czego powstały H2, CO, CH3OH i inne użyteczne gazy reaktywne, jak pokazano na czerwonej krzywej utraty masy.
Cały proces można opisać w następujący sposób: Węgiel reaguje z parą wodną, tworząc mieszaninę tlenku węgla i wodoru. Powstały tlenek węgla może reagować z drugą cząsteczką wody, tworząc dwutlenek węgla i dalszy wodór, a na koniec powstały wodór może tworzyć metan i inne węglowodory z tlenku węgla.
Przykład zastosowania: Badanie zachowania podczas spalania i zawartości popiołu w materiałach kompozytowych
Wreszcie, materiały kompozytowe muszą być poddane recyklingowi lub wykorzystane do produkcji energii po zakończeniu okresu użytkowania produktu. W tym celu interesujące może być zbadanie zachowania podczas spalania i zawartości popiołu.
Materiały węglowe, substancje organiczne i polimery zazwyczaj spalają się po podgrzaniu. Badanie rozkładu termicznego takich materiałów jest zatem nieco wyspecjalizowane. W większości przypadków przeprowadza się je w atmosferze obojętnej zamiast powietrza w celu zaobserwowania efektów rozkładu i pirolizy, a następnie wymiany gazowej na tlen lub powietrze, co prowadzi do wypalenia zawartego węgla.
Jeśli proces ten zostanie przeprowadzony na kombinowanym analizatorze termicznym (STA), można zmierzyć zawartość węgla, zawartość nieorganiczną i uwolnione ciepło.
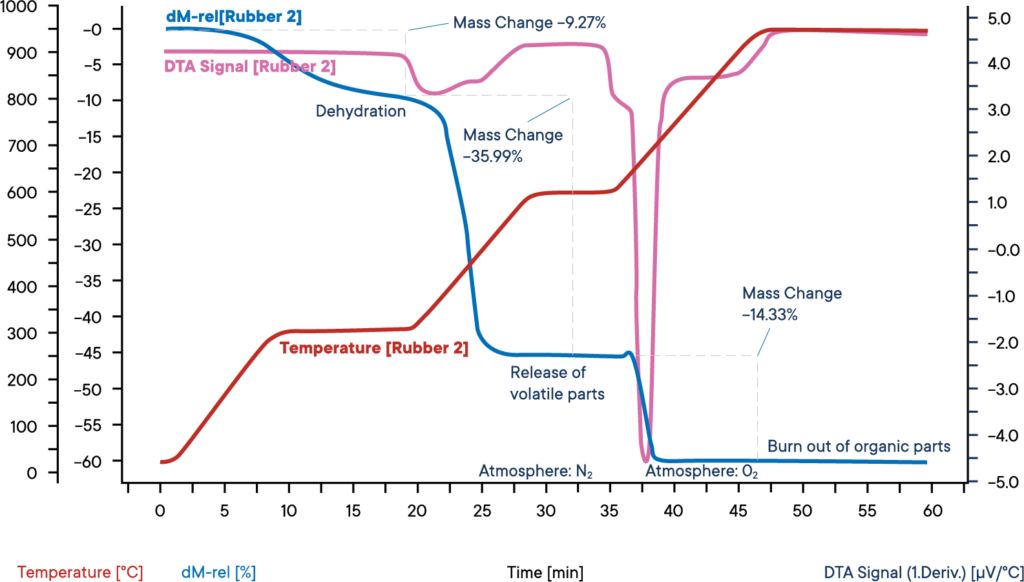
Pomiar próbki gumy przemysłowej został przeprowadzony za pomocą termobalansu symultanicznego STA L81 w atmosferze azotu.
Próbkę ogrzewano w trzech etapach, każdy z prędkością 30 K/min. Niebieska krzywa pokazuje względną utratę masy. Odwodnienie próbki następuje w pierwszym etapie utraty masy. Zawartość wody wynosiła 9,3%. Odpowiedni sygnał DTA (fioletowa krzywa) nie wykazał żadnego wpływu podczas odparowywania wody.
W drugim etapie reakcji lotne składniki są uwalniane przez pirolizę w atmosferze N2. Udział tych składników wynosi 36,0%. Ich uwalnianie można rozpoznać po egzotermicznym piku reakcji na krzywej DTA.
W trzecim etapie reakcji atmosfera jest przełączana na O2, co prowadzi do spalania pozostałego węgla. Utrata masy wynosi 14,3%. Pozostałe 40,4% to składniki nieorganiczne, takie jak popiół, żużel lub wypełniacze.
2. przekształcanie energii elektrycznej w energię chemiczną (elektroliza, paliwa syntetyczne)
Elektroliza wody polega na chemicznym rozszczepieniu wody na tlen i wodór poprzez przyłożenie zewnętrznego napięcia. Ponieważ ten proces produkcji wodoru wymaga dużej ilości energii, stosuje się również procesy, które wytwarzają wodór za pomocą katalizatorów lub łańcuchów reakcji, takich jak zgazowanie węgla.
Celem jest jednak osiągnięcie bezpośredniej elektrolizy o wysokiej wydajności i sprawności. Aby poprawić wydajność elektrolizy, należy zoptymalizować materiały katody i anody, a także katalizatory i materiały powierzchniowe.
Ponieważ energia elektryczna jest trudna do zmagazynowania, dzisiejsze duże elektrownie, takie jak elektrownie węglowe i jądrowe, wytwarzają stałą ilość energii w celu pokrycia obciążenia podstawowego, podczas gdy bardziej zmienne elektrownie, takie jak elektrownie gazowe, są wykorzystywane do kompensowania wahań.
Ponieważ wytwarzanie energii elektrycznej z odnawialnych źródeł energii podlega wahaniom (np. w nocy, podczas suszy lub gdy nie ma wiatru), wytworzona energia musi być magazynowana w celu pokrycia zapotrzebowania na ciągłe i zmienne zapotrzebowanie na energię przy przerywanym wytwarzaniu energii z odnawialnych źródeł energii.
Ponadto niektóre aplikacje, takie jak mobilność (samochody, ciężarówki, samoloty dalekiego zasięgu), wymagają dużych ilości energii. Przechowywanie energii elektrycznej w akumulatorach nie jest praktyczne, ponieważ akumulatory o wymaganej wielkości są drogie i nie są gotowe do użycia. Dla tych zastosowań korzystniejsze jest przekształcanie energii elektrycznej w energię chemiczną w postaci paliw syntetycznych lub wodoru. Ponieważ paliwa syntetyczne są również wytwarzane z wodoru, najważniejszym krokiem jest produkcja wodoru z wody w procesie elektrolizy.
Przykład zastosowania: Katalizatory – Rozszerzalność cieplna drutów platynowych
 Analiza termiczna może tu pomóc poprzez scharakteryzowanie zastosowanych materiałów pod względem stabilności chemicznej, przewodności cieplnej i zdolności sorpcyjnej, ale także poprzez określenie rozszerzalności cieplnej w celu poprawy żywotności i jakości.
Analiza termiczna może tu pomóc poprzez scharakteryzowanie zastosowanych materiałów pod względem stabilności chemicznej, przewodności cieplnej i zdolności sorpcyjnej, ale także poprzez określenie rozszerzalności cieplnej w celu poprawy żywotności i jakości.
Platyna jest stosowana jako katalizator, jako czysty materiał lub w wielu stopach. Ponieważ zastosowanie jako stop jest bardziej powszechne ze względu na różne zalety stopu, zachowanie fizyczne i chemiczne zmienia się nieznacznie. Przykład pokazuje różnicę w rozszerzalności cieplnej między platyną a platyną z dodatkiem 3% rodu.
W tym przykładzie platyna i stop platyny zostały zmierzone w dylatometrze prętowym Linseis z liniową szybkością ogrzewania 5 K/min. Dwie dolne krzywe przedstawiają bezwzględną rozszerzalność cieplną, a górne krzywe względną rozszerzalność próbki platyny w porównaniu ze stopem platyny i rodu.
Nawet przy niewielkiej różnicy w składzie chemicznym, rozszerzalność wykazuje odchylenia rzędu kilku μm w zakresie do 1000 °C. W przypadku zastosowania w złożonej strukturze, takiej jak reaktor, należy wziąć pod uwagę dokładne wartości rozszerzalności, aby uniknąć uszkodzenia jednostki elektrolizy z powodu różnych współczynników rozszerzalności.

Przykład zastosowania: Zarządzanie ciepłem – przewodność cieplna grafitu
Oprócz rozszerzalności cieplnej, która może powodować problemy w złożonej strukturze, bardzo ważne są również właściwości termofizyczne, takie jak przewodność cieplna i opór właściwy.
 Kluczem jest prawidłowe zarządzanie temperaturą. Jeśli w reaktorze nie występują duże różnice temperatur, nie będzie problemów z rozszerzalnością cieplną. Z tego powodu dobrze jest również znać właściwości transportu termicznego wszystkich użytych materiałów.
Kluczem jest prawidłowe zarządzanie temperaturą. Jeśli w reaktorze nie występują duże różnice temperatur, nie będzie problemów z rozszerzalnością cieplną. Z tego powodu dobrze jest również znać właściwości transportu termicznego wszystkich użytych materiałów.
Podsumowując: Optymalizacja właściwości termofizycznych pomaga obniżyć koszty i poprawić jakość. Na przykład katalizatory nanostrukturalne mają większą powierzchnię aktywną i wymagają mniej surowców.
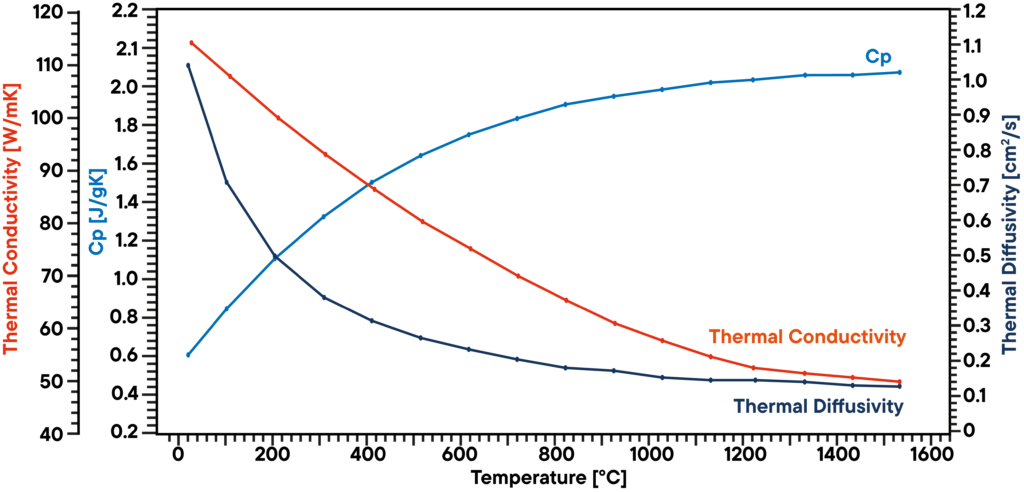
Grafit to rodzaj węgla, który występuje w postaci ciemnoszarego ciała stałego. Charakteryzuje się niezwykle wysoką odpornością chemiczną i jest wykorzystywany na wiele różnych sposobów, np. jako materiał katodowy, materiał konstrukcyjny, element czujników i wiele innych. Po podgrzaniu reaguje z tlenem, tworząc tlenek węgla lub dwutlenek węgla, ale może osiągać bardzo wysokie temperatury po podgrzaniu w obojętnym, pozbawionym tlenu środowisku i dlatego jest stosowany jako materiał do pieców, a nawet jako grzejnik w piecach ultra-wysokotemperaturowych.
W tym przykładzie próbka grafitu była analizowana w próżni przy użyciu analizatora LFA 1000 (Laserflash Analyzer). Dyfuzyjność cieplna została zmierzona bezpośrednio w kilku stopniach temperatury pomiędzy RT a 1100°C. Pojemność cieplna właściwa została określona za pomocą znanego wzorca grafitu w drugiej pozycji próbki jako odniesienie w tym samym pomiarze.
Iloczyn dyfuzyjności cieplnej, ciepła właściwego i gęstości daje odpowiednią przewodność cieplną. Wynik pokazuje liniowo malejącą przewodność cieplną, co jest typowe, oraz dyfuzyjność cieplną, która wykazuje plateau powyżej 500°C. Wartość Cp nieznacznie wzrasta wraz z temperaturą.
Przykład zastosowania: Paliwo syntetyczne – reakcje zależne od ciśnienia spowodowane wysokim ciśnieniem STA
W przypadku niektórych zastosowań, takich jak samoloty, korzystne może być wiązanie energii elektrycznej w bardziej stabilnej formie niż wodór, czym są paliwa syntetyczne.
Paliwa syntetyczne mają tę wielką zaletę, że istniejąca infrastruktura i konstrukcje mogą być wykorzystywane w niezmienionej formie. Pomysł polega na wykorzystaniu zielonego wodoru i produkcji z niego syntetycznych węglowodorów. CO2 jest wychwytywany z atmosfery podczas procesu produkcji, ale CO2 jest ponownie uwalniany, gdy paliwo syntetyczne jest wykorzystywane (spalane).
Proces produkcji paliw syntetycznych (proces Fischera-Tropscha) można zoptymalizować za pomocą wysokociśnieniowych systemów TG i TG/DSC, takich jak LINSEIS High Pressure -STA.
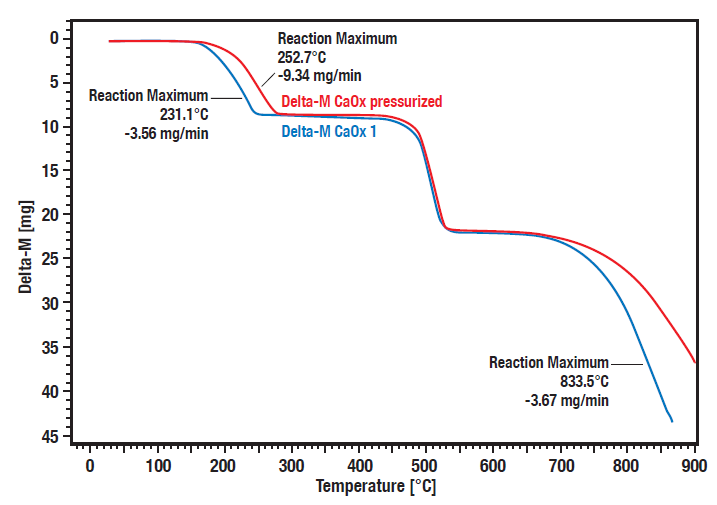
Seria Linseis STA HP umożliwia pomiary pod kontrolowanym, podwyższonym ciśnieniem. W przypadku niektórych reakcji, takich jak rozkład, adsorpcja i desorpcja, zachowanie próbek i materiałów jest w dużym stopniu zależne od warunków atmosferycznych, ponieważ w wielu reakcjach występuje zależność od ciśnienia.
Krzywe te pokazują porównawczy pomiar rozkładu hydratu szczawianu wapnia pod ciśnieniem (20 barów, krzywa czerwona) w porównaniu z warunkami atmosferycznymi (krzywa niebieska). Widoczna jest wyraźna zależność od ciśnienia etapów rozkładu 1 (utrata wody) i 3 (utrata dwutlenku węgla).
Etapy rozkładu 1 i 3 są przesunięte do wyższych temperatur przy zwiększonym ciśnieniu. Drugim etapem jest nieodwracalna konwersja organicznego szczawianu do nieorganicznego węglanu z uwolnieniem tlenku węgla. Ponieważ proces ten nie jest odwracalny, nie zależy on od ciśnienia.
3. magazynowanie wodoru
Ponieważ wodór jest gazem bardzo lotnym, jego magazynowanie i transport stanowią poważne wyzwanie. Można go przechowywać w butlach poprzez sprężanie gazu H2, ale ze względu na wymagane wysokie ciśnienie (istnieją butle o maksymalnym ciśnieniu do 700 barów) oraz związane z tym kwestie technologiczne i bezpieczeństwa (wodór z czasem dyfunduje przez dowolny materiał), preferowane są inne technologie.
Na przykład, wodór może być przechowywany poprzez sorpcję na różnych materiałach, w których jest on mniej lub bardziej utrwalony chemicznie (struktury metaloorganiczne (MOF), zeolity, ciecze jonowe itp. Jednak najbardziej obiecujące jest przechowywanie go w postaci wodorku metalu.
W tym przypadku wodór jest chemicznie wiązany z powierzchnią metalu, tworząc stabilny wodorek. Proces ten można zoptymalizować poprzez zwiększenie powierzchni poprzez zastosowanie porowatych materiałów, takich jak zeolity i syntetyczne rusztowania z nanoporami. W wielu materiałach wodór może być następnie uwalniany poprzez kontrolowane zmiany temperatury lub łatwo stosowane zmiany ciśnienia. Ryzyko niekontrolowanej dyfuzji już nie istnieje.
Przykład zastosowania: Wysokociśnieniowa sorpcja STA
Analizy termiczne, w szczególności analizy grawimetryczne mogą pomóc w określeniu dokładnych warunków sorpcji, szybkości uwalniania i przechowywania w celu optymalizacji cykli ładowania i uwalniania.
Pomiar sorpcji, który jest przeprowadzany przy użyciu metod objętościowych, zwykle nie dostarcza żadnych informacji na temat przepływu ciepła i entalpii. Jeśli ciepło sorpcji jest interesujące, wymagany jest drugi eksperyment.
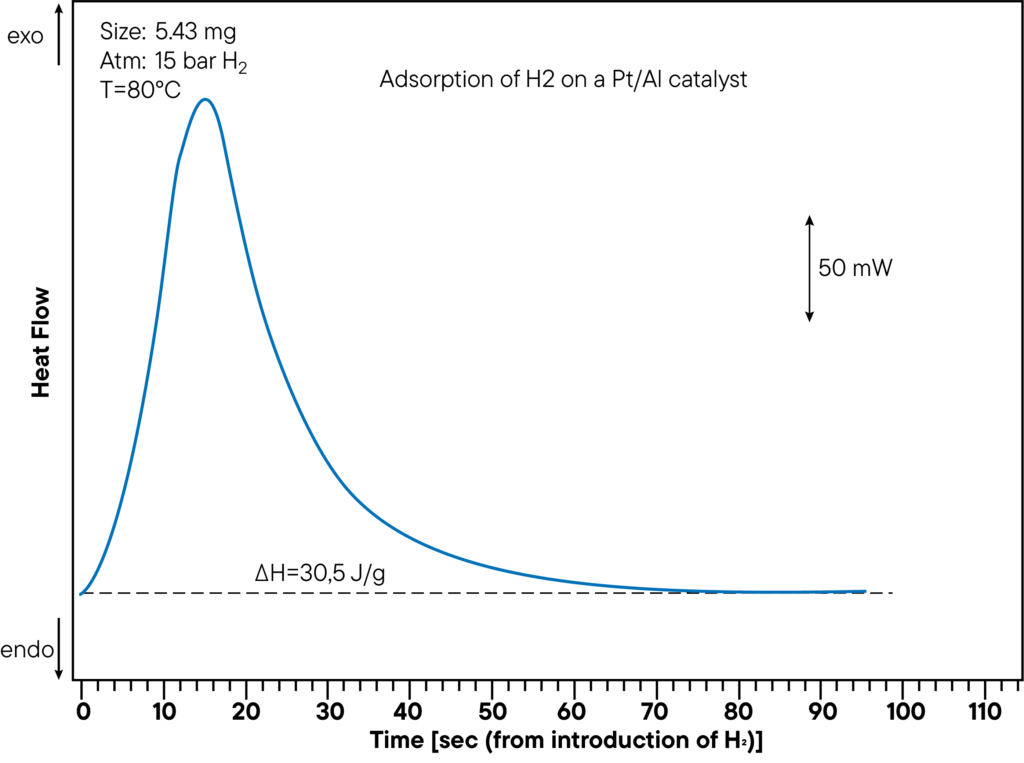
Grawimetryczny analizator sorpcji ( wysokociśnieniowy TG-DSC ), który mierzy zarówno zmianę masy (termograwimetria TGA), jak i sygnał różnicowej kalorymetrii skaningowej (DSC), stanowi znacznie szybszą alternatywę.
W ramach testu można zmierzyć zarówno pojemność sorpcyjną, jak i ciepło sorpcji. Rysunek przedstawia sekcję pomiarową DSC adsorpcji wodoru na katalizatorze Pt/Al przy ciśnieniu 15 bar i temperaturze 80°C. Wytworzone ciepło wynosi 30,5 J/g. Ciepło sorpcji zostało określone bezpośrednio podczas eksperymentu sorpcji i wykazuje wyraźny pik. Na powyższej krzywej monitorowano czas od wstrzyknięcia wodoru do reakcji sorpcji, aby pokazać, jak szybko próbka wchodzi w interakcję z atmosferą.
4. urządzenia i procesy wykorzystujące wodór jako paliwo
Po wyprodukowaniu i zmagazynowaniu wodoru, który jest dostępny do (mobilnego) użytku, jego wysoka gęstość energii umożliwia szeroką gamę zastosowań.
Najczęstsze zastosowania to jako środek redukujący, paliwo, gaz nośny i do syntezy cząsteczek, takich jak węglowodany, amoniak i wiele innych. Jednym z często wykorzystywanych zastosowań jest spiekanie metali.
Elementy metalowe lub zawierające tlenki metali są często wytwarzane poprzez zagęszczanie proszków w tak zwane zielone ciała. Te zielone korpusy są następnie zestalane przez podgrzanie ich do temperatury poniżej temperatury topnienia, proces znany jako spiekanie. Podczas spiekania wymiary są zmniejszane. W związku z tym proces spiekania można analizować poprzez pomiar wymiarów. Zwykle odbywa się to za pomocą dylatometru (patrz przykład zastosowania).
Aby uniknąć utleniania, a także zmniejszyć zawartość tlenków w produkcie końcowym, spiekanie może odbywać się w atmosferze zawierającej wodór lub nawet w atmosferze czystego wodoru.
Dzięki specjalistycznej wiedzy w zakresie technologii bezpieczeństwa wodorowego firma LINSEIS jest w stanie dostarczać dylatometry do użytku w atmosferze czystego wodoru. Dylatometr może być wykorzystywany do pomiarów spiekania lub rozprężania wodoru w atmosferze redukcyjnej. Odgazowanie jest sprzężone z bezpieczną jednostką spalania, a system jest podłączony do detektora wodoru, który może wyłączyć system i oczyścić go gazem obojętnym w przypadku niekontrolowanego uwolnienia wodoru.
Przykład zastosowania: Spiekanie H2 proszków metali
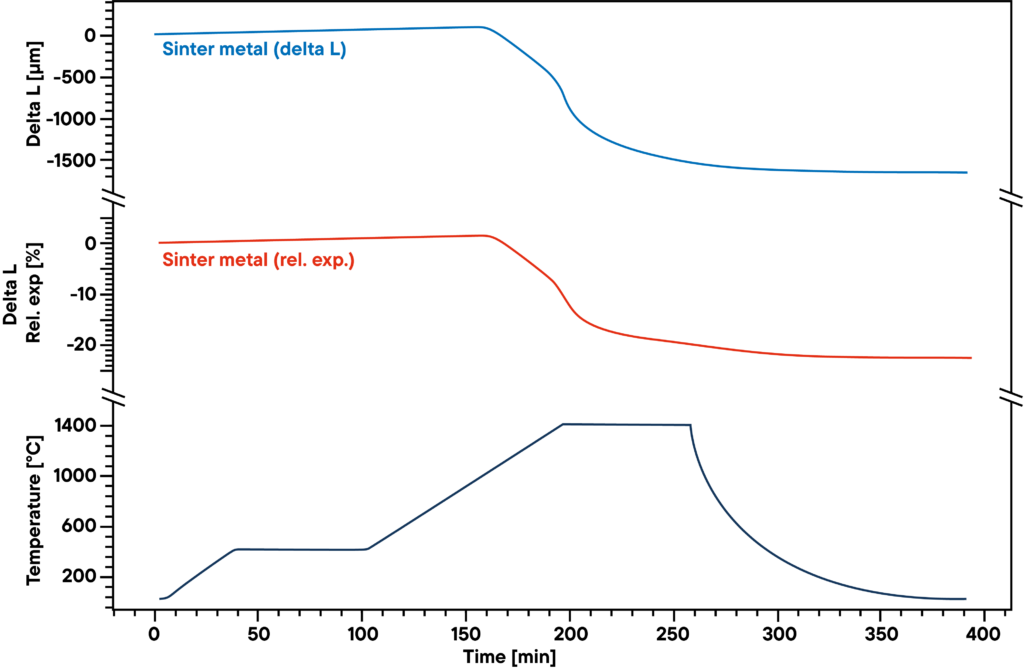
Przykład pokazuje spiekanie wodorem zielonych ciał z proszków metali, które są używane jako katalizatory.
Pomiar pokazuje krzywą spiekania prasowanego spiekanego proszku metalu, który był ogrzewany w atmosferze wodoru absolutnego zgodnie z profilem spiekania (dolna krzywa).
Wodór redukuje tlen zawarty w próbce podczas procesu spiekania, co skutkuje wyższą gęstością i niższą zawartością tlenków metali. Dlatego zarówno atmosfera gazowa, jak i profil spiekania mają znaczący wpływ na wyniki.
Niebieska krzywa pokazuje względne rozszerzanie i kurczenie, czerwona krzywa pokazuje wartości bezwzględne. Główny etap spiekania można zaobserwować w drugiej fazie ogrzewania między 500°C a 1400°C.
5. technologia ogniw paliwowych
Jednak najciekawszym i najczęściej wymienianym zastosowaniem wodoru są ogniwa paliwowe, które mogą być wykorzystywane w wielu różnych sytuacjach, od zasilania budynków w energię elektryczną i ciepło po zasilanie samochodów o zwiększonym zasięgu. Są one kluczowym elementem przekształcania zmagazynowanej energii wodoru z powrotem w energię elektryczną.
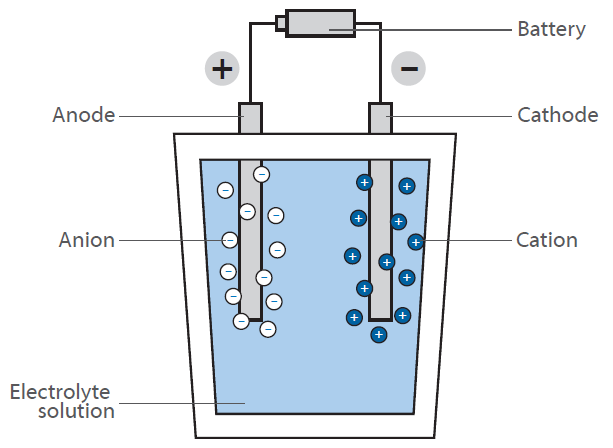
W ogniwie paliwowym wodór reaguje z powietrzem, tworząc wodę. Reakcja ta nie jest wykorzystywana bezpośrednio przez spalanie z uwolnieniem ciepła, ale w ogniwie paliwowym do generowania energii elektrycznej: Rysunek przedstawia schemat wodorowego ogniwa paliwowego.
Jego zadaniem jest generowanie energii elektrycznej „na żądanie” poprzez reakcję wodoru i tlenu. W przeciwieństwie do klasycznej, bezpośredniej reakcji, w której woda powstaje z dużym wydzieleniem energii w postaci ciepła (wyobraźmy sobie mieszaninę wodoru i tlenu, która zostaje zapalona), ogniwo paliwowe posiada dwie komory, w których znajdują się oba związki.
W środku tych komór znajduje się membrana, która umożliwia dyfuzję wodoru, ale nie innych cząsteczek. Na powierzchni membrany po stronie komory tlenowej zachodzi reakcja wodoru i tlenu, wytwarzając wodę, która jest wyprowadzana z komórki. Prowadzi to do spadku stężenia wodoru na membranie i powoduje migrację większej ilości cząsteczek wodoru do membrany.
Dyfuzja wodoru do komory zawierającej tlen generuje napięcie elektryczne na membranie. Jest to energia, która jest teraz uwalniana zamiast ciepła i może być wykorzystana do zasilania silnika.
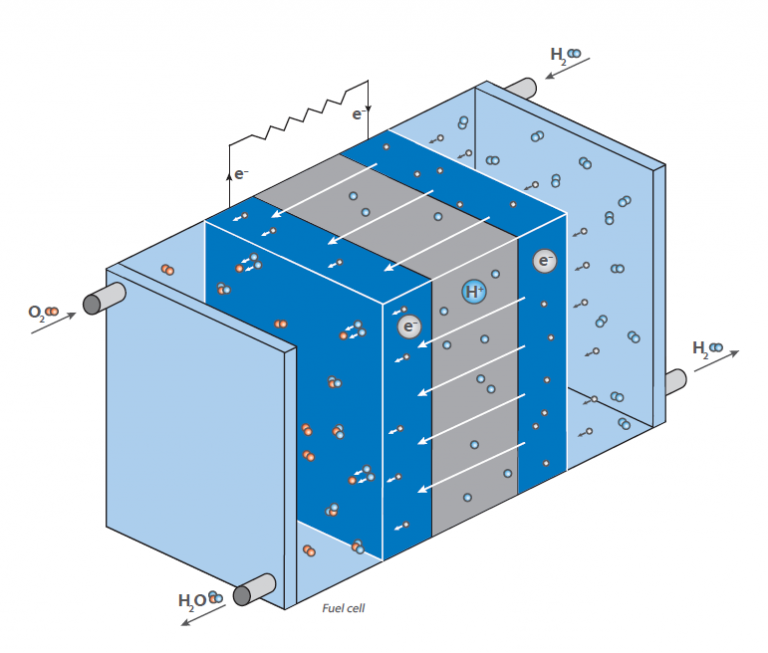
Ponieważ stężenie wodoru w komorze wodorowej można regulować, szybkość dyfuzji na membranie można łatwo kontrolować, podobnie jak w silniku benzynowym. Wodór można zatem traktować jako „paliwo”. Membrana pokryta jest materiałem elektrodowym składającym się z metali szlachetnych. Metale te działają jak katalizator i wpływają na warunki pracy ogniwa paliwowego (temperatura, napięcie itp.).
Ponieważ ogniwa paliwowe zasilane wodorem mogą pracować w wysokich temperaturach sięgających 1000°C, a lutowie używane do ich montażu musi być stabilne termicznie, chemicznie i mechanicznie, w tym miejscu ponownie pojawia się analiza termiczna. Warunki pracy ogniw paliwowych zależą od zastosowanych materiałów, które mogą działać jak katalizatory.
Na przykład wszystkie techniki wykorzystywane do charakteryzowania katalizatorów mają zastosowanie w technologii wodorowej/ogniw paliwowych. W związku z tym potrzebna jest duża wiedza z zakresu materiałoznawstwa, a wiele technik analitycznych pomaga w analizie materiałów. W tym przypadku skupimy się na technikach analizy termicznej.
W niektórych zastosowaniach związanych z magazynowaniem wodoru panuje wysokie ciśnienie, niekiedy przekraczające 100 barów, dlatego przydatne są analizatory ciśnieniowe. Ponadto wszystkie techniki analizy wymagają środków ostrożności ze względu na wysoką reaktywność wodoru z tlenem/powietrzem. W związku z tym wszystkie analizatory muszą być wyposażone w funkcje bezpieczeństwa, aby uniknąć ryzyka wybuchu.
Przykład zastosowania: Uwalnianie wodoru z magazynów powierzchniowych
Poniższy przykład zastosowania pokazuje, gdzie urządzenia do analizy termicznej i materiałoznawstwa są wykorzystywane w dziedzinie ogniw paliwowych.
Magazynowanie wodoru może przybierać formę adsorpcji powierzchniowej, adsorpcji w porach lub absorpcji chemicznej. W przypadku większości metali adsorpcja powierzchniowa jest najbardziej obiecującą drogą, ponieważ jest łatwa do osiągnięcia, a uwalnianie wodoru może być bardzo dobrze kontrolowane. Dlatego też badanych jest wiele metali o wysokiej powierzchni właściwej.
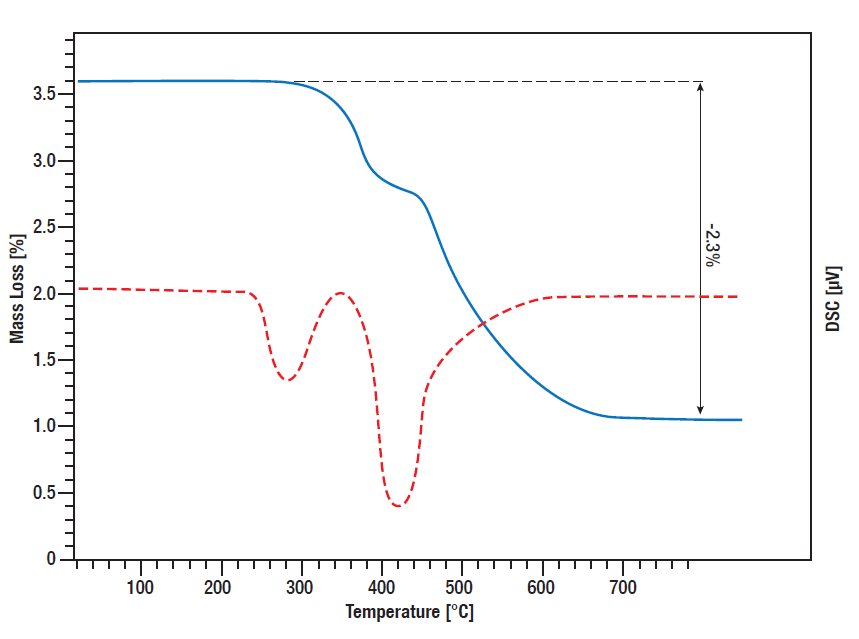
Wodorek tytanu jest często wykorzystywanym źródłem wodoru do kontrolowanego uwalniania wodoru w różnych reakcjach. Z jednej strony może być stosowany jako katalizator w chemii cieczy in situ jako źródło wodoru, a z drugiej strony może być stosowany na przykład w bateriach lub ogniwach paliwowych do kontrolowanego uwalniania wodoru.
Aby dowiedzieć się, jaka ilość wodoru jest uwalniana w jakiej temperaturze, ważne jest, aby znać zależne od temperatury zachowanie rozkładu i ilość uwalnianego ciepła, które można monitorować za pomocą jednoczesnej analizy termicznej (STA).
W tym pomiarze STA monitorowano uwalnianie wodoru przez wodorek tytanu. Sygnał TG i DSC mierzono od temperatury pokojowej do 800°C, podczas gdy próbkę ogrzewano liniowo w atmosferze argonu z prędkością 10 K/min. Pomiędzy 300°C a 600°C występuje dwustopniowa utrata masy wynosząca 2,3%, co oznacza, że cała ilość związanego wodoru jest uwalniana w tym procesie. Krzywa DSC pokazuje odpowiednie piki desorpcji (czerwona krzywa).
Bezpieczeństwo pomiarów wodoru
Wodór ma wysokie powinowactwo do czynników utleniających i powierzchni metalowych, a także do tlenu. Tworzenie wody z pierwiastków (2 – H2 + O 2 = 2 – H2O; ΔH = 286 kJ/mol) jest reakcją egzotermiczną, dlatego wodór jest uważany za potężny magazyn energii.
Mieszaniny wodoru i powietrza o zawartości wodoru przekraczającej ok. 4% są potencjalnie wybuchowe. Energia aktywacji (bez katalizatora) jest wysoka, ale w obecności płomienia, iskry lub wysokiej temperatury takie mieszaniny mogą się spalić lub wybuchnąć. W związku z tym wymagane są pewne środki ostrożności w przypadku analizy termicznej ze stężeniem wodoru większym niż 4% w powietrzu.
Wszystkie analizatory termiczne LINSEIS do zastosowań związanych z wodorem mogą być wyposażone w następujące funkcje bezpieczeństwa:

- Detektory wodoru: wykrywają wszelkie wycieki w rurach gazowych. Detektory te są umieszczone w pobliżu urządzenia i wykrywają wszelkie wycieki lub przypadkowe uwolnienie wodoru.
- Płukanie gazem obojętnym: W przypadku wykrycia nieszczelności i zatrzymania dopływu wodoru, pozostały w analizatorze wodór jest wypłukiwany gazem obojętnym.
- Zawory bezpieczeństwa:
Po wykryciu wycieku wodoru aktywowane są zawory bezpieczeństwa, które przerywają dopływ wodoru do analizatora termicznego.
- Jednostka odprowadzająca odgazowanie:
Wszystkie systemy wodorowe Linseis są wyposażone w jednostkę pochodni na przyłączu odgazowania. Odgazowane gazy (gaz próbny, gaz oczyszczający i produkty rozkładu) przechodzą przez stale płonący płomień, aby zapewnić, że żadne łatwopalne gazy nie zostaną uwolnione do środowiska i nie osiągną krytycznego stężenia w laboratorium. Płomień jest ogrzewany elektrycznie i posiada mechanizm zabezpieczający, który zapobiega cofnięciu się płomienia do przewodów gazowych.
