Spis treści
Wprowadzenie: Znaczenie stabilności białek
Zrozumienie stabilności białek ma fundamentalne znaczenie dla współczesnej biochemii, badań farmaceutycznych i biotechnologii. Stabilność białka określa nie tylko to, jak długo białko terapeutyczne może pozostać aktywne w roztworze, ale także jego przydatność do formulacji, przechowywania i transportu (Wang 1999). Od inżynierii enzymatycznej po opracowywanie leków i badania biologii strukturalnej, zdolność do dokładnej oceny i optymalizacji stabilności białek umożliwia badaczom i innowatorom rozwój zastosowań w naukach przyrodniczych przy jednoczesnym minimalizowaniu ryzyka związanego z agregacją, denaturacją lub utratą aktywności.
Ostatnie publikacje podkreślają rolę stabilności białek w formulacji leków i bioprzetwarzaniu – gdzie nawet niewielkie zmiany w składzie buforu lub temperaturze mogą znacząco wpłynąć na fałdowanie białek i wyniki terapeutyczne (Durowoju et al. 2017).
Czynniki wpływające na stabilność białek
Funkcjonowanie białek jest krytycznie zależne od integralności ich trójwymiarowej struktury – natywnej konformacji. Struktura ta może być zaburzona przez różne czynniki fizykochemiczne:
- Temperatura: Podwyższona temperatura może rozłożyć białka, powodując nieodwracalną utratę funkcji lub agregację.
- pH: Zmiany pH zakłócają interakcje jonowe i wiązania wodorowe, wpływając na stabilność strukturalną.
- Siła jonowa: Sole mogą stabilizować lub destabilizować białka w zależności od specyficznych interakcji z naładowanymi łańcuchami bocznymi.
- Wiązanie ligandów: Małe cząsteczki, kofaktory lub leki wiążące się z białkami mogą stabilizować lub destabilizować określone konformacje (Durowoju et al. 2017).
- Mutacje genetyczne: Pojedyncze mutacje punktowe mogą zwiększać lub zmniejszać stabilność, wpływając na zachowanie białka w warunkach fizjologicznych.
Systematyczne badania pokazują, że dostosowanie składu chemicznego buforu i kontrolowanie temperatury podczas obsługi i przechowywania są jednymi z najbardziej skutecznych interwencji w celu zachowania aktywności białka (Wang 1999).
Podstawy: Co oznacza stabilność białka?
Stabilność białka odnosi się do odporności natywnej struktury białka w różnych warunkach. Obejmuje ona:
- Stabilność termodynamiczna: Tendencja białka do pozostawania w stanie zwiniętym zamiast denaturacji.
- Stabilność kinetyczna: Szybkość, z jaką białko przechodzi do stanu rozłożonego lub zagregowanego.
- Zmiany odwracalne: Niektóre przejścia fałdowania mogą być odwrócone poprzez przywrócenie łagodnych warunków (np. ponowne fałdowanie po łagodnej denaturacji).
- Nieodwracalne zmiany: Poważne przetwarzanie (np. wysokie temperatury lub czynniki chemiczne) może prowadzić do agregacji lub rozwinięcia, których nie można odwrócić.
Stabilność jest często określana ilościowo przez temperaturę topnienia (Tm), w której połowa populacji białek ulega denaturacji – kluczowy parametr mierzony w testach stabilności (Durowoju et al. 2017).
Metody oceny stabilności białek
Opracowano wiele ortogonalnych technik do badania stabilności biomolekularnej i interakcji. Wybór odpowiedniej metody zależy od pytania badawczego, typu białka i dostępnego oprzyrządowania.
Różnicowa kalorymetria skaningowa (DSC)
DSC jest niezbędnym narzędziem do precyzyjnych badań stabilności białek (Durowoju et al. 2017). Mierząc ciepło wymagane do rozwinięcia próbki białka wraz ze wzrostem temperatury, DSC określa:
- Temperatura denaturacji (Tm): Wskazuje stabilność termiczną.
- Zmiany entalpii (ΔH): Ujawnia przejścia energii fałdowania.
- Profile rozwijania: Scharakteryzuj odwracalne lub nieodwracalne przejścia.
DSC jest ceniona za dokładność w wykrywaniu subtelnych przejść – nawet dla białek w niskich stężeniach – i jest szczególnie skuteczna w charakteryzowaniu wariantów, zachowania formulacji termicznej i zmian stabilności wywołanych ligandami (Qualification of a DSC Method 2020).
Inne metody analityczne
Dynamiczne rozpraszanie światła (DLS): Mierzy promień hydrodynamiczny i wykrywa agregację białek, uzupełniając testy stabilności termicznej stabilności termicznej (Mirasol et al. 2021).
Spektroskopia UV-Vis: Monitoruje rozwijanie poprzez śledzenie zmian absorbancji związanych z aromatycznymi łańcuchami bocznymi lub chromoforami.
Izotermiczna kalorymetria miareczkowa (ITC): Ilościowo określa interakcje wiązania między białkami i ligandami; przydatna do wykrywania zmian stabilności po przyłączeniu ligandu (Durowoju et al. 2017).
Spektroskopia dichroizmu kołowego (CD): Bada zmiany struktury drugorzędowej podczas fałdowania lub denaturacji (np. przejścia alfa-helisy do beta-arkusza).
Badanie interakcji wpływających na stabilność
Białka nieustannie wchodzą w interakcje ze swoim środowiskiem molekularnym. Ocena wpływu tych interakcji na stabilność ma kluczowe znaczenie dla badań i rozwoju:
- Wiązanie ligandów: DSC i ITC są wykorzystywane do określania powinowactwa wiązania oraz stabilizującego lub destabilizującego wpływu małych cząsteczek, leków i kofaktorów (Durowoju et al. 2017).
- Agregacja białek: DLS identyfikuje zmiany w skłonności do agregacji podczas ekspozycji na ciepło lub stres (Wang 1999).
- Zależność od pH: Przeprowadzając badania DSC przy różnych wartościach pH, naukowcy uzyskują wgląd w rolę stanów protonacji w fałdowaniu.
- Warianty genetyczne: Porównanie Tm lub profili agregacji za pomocą DSC i DLS pozwala na ocenę stabilności wynikającej z mutacji punktowych lub zmian sekwencji (Mirasol et al. 2021).
Jak metody termiczne oświetlają interakcje molekularne
Techniki termiczne, takie jak DSC nie tylko dają Tm i entalpię, ale w połączeniu z protokołami miareczkowania ligandów lub buforów zapewniają głęboki wgląd w powinowactwo wiązania i stabilizację strukturalną (Durowoju et al. 2017). Na przykład ligand, który zwiększa Tm białka, sugeruje bezpośrednią interakcję stabilizującą istotną dla projektowania lub formulacji leku.
Praktyczne spostrzeżenia i parametry pomiarowe
Interpretacja danych dotyczących stabilności białek wymaga zwrócenia uwagi na warunki eksperymentalne i typowe wyniki:
- Szybkość ogrzewania: Wpływa na wykrywanie stabilności kinetycznej i termodynamicznej; wolniejsze tempo sprzyja pomiarom równowagi.
- Stężenie próbki: Wystarczające stężenie zapewnia niezawodny sygnał bez zakłóceń agregacji.
- Skład buforu: Porównanie stabilizującego wpływu różnych buforów i substancji pomocniczych na Tm i entalpię rozwijania (Wang 1999).
- Próbki kontrolne: Zawsze porównuj z dobrze zdefiniowanymi standardami – takimi jak białka typu dzikiego vs. zmutowane lub kontrole tylko buforowe.
Zastosowanie
Przykładowe aplikacje
- Porównanie profili stabilności przeciwciał monoklonalnych na potrzeby opracowywania formulacji (Qualification of a DSC Method 2020).
- Ocena wariantów enzymów dla biokatalizy przemysłowej wymagającej odporności termicznej.
- Badanie powinowactwa wiązania białko-ligand na wczesnym etapie odkrywania leków i biologii strukturalnej (Durowoju et al. 2017).
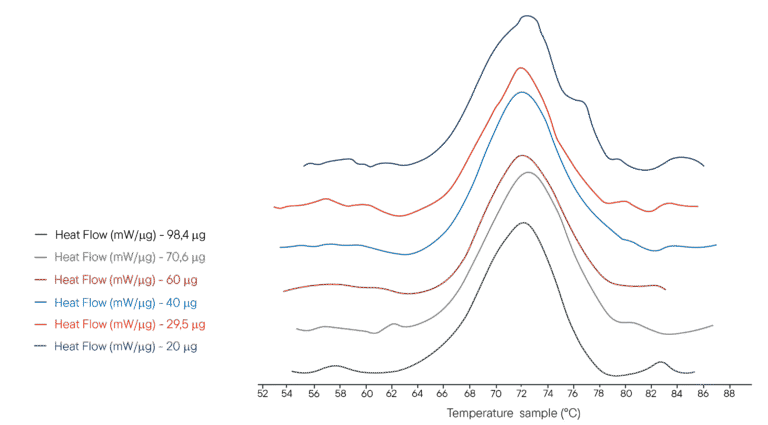
Przykład zastosowania: Denaturacja termiczna lizozymu
100 µl kilku roztworów lizozymu w buforze PHB umieszczono w tyglu o pojemności 100 µl. Zastosowano różne stężenia, reprezentujące odpowiednio różne masy analizowanego lizozymu. Tygiel referencyjny wypełniono taką samą objętością buforu PHB. Aparat Ultimate DSC zaprogramowano tak, aby wykonywał rampę temperaturową od 40°C do 95°C z prędkością 1°C/min.
Uzyskane termogramy pokazano po prawej stronie. Ultimate DSC umożliwia pomiar entalpii i temperatury denaturacji lizozymu przy użyciu od 5 do 10 próbek mniej niż obecnie dostępne urządzenia. Każdy termogram został uzyskany w czasie krótszym niż 60 minut, umożliwiając szybką analizę. Ultimate DSC oszczędza duże ilości próbek i pozwala na szybszą pracę.
Wybór odpowiedniej metody do badań
Wybór optymalnej metody analitycznej zależy od konkretnego białka, celu badań i dostępnych zasobów:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
W celu szczegółowego porównania, ostatnie przeglądy podkreślają, w jaki sposób integracja wielu technik, w tym precyzyjnych pomiarów kalorymetrycznych i spektroskopowych, prowadzi do solidnej oceny stabilności białek i przydatności do dalszych zastosowań (Mirasol et al. 2021; Durowoju et al. 2017).
Wnioski i kolejne kroki
Zrozumienie i kontrolowanie stabilności białek ma kluczowe znaczenie dla udanych badań biomolekuł, formulacji farmaceutycznych i opracowywania leków. Analiza termiczna, w szczególności przy użyciu DSC, zapewnia solidny, wymierny wgląd w zachowanie białek w praktycznych warunkach, pomagając w podejmowaniu decyzji opartych na danych.
Jeśli chcesz przyspieszyć badania stabilności białek, Linseis UDSC L64 zapewnia najnowocześniejsze kalorymetryczne dostosowane do analizy biomolekularnej i opracowywania receptur. Dowiedz się więcej o wydajności i wszechstronnym spektrum zastosowań UDSC L64 na naszej stronie rozwiązań kalorymetrycznych lub skontaktuj się z naszym wyspecjalizowanym zespołem w celu uzyskania indywidualnych konsultacji dotyczących Twoich potrzeb badawczych.
Wybrana literatura do dalszej lektury
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. i Kirkitadze, M. (2017) Differential Scanning Calorimetry-A Method for Assessing the Thermal Stability of Proteins, Journal of Visualized Experiments, (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- Wang, W. (1999) „Instability, stabilization, and formulation of liquid protein pharmaceuticals”, International Journal of Pharmaceutics, 185(2), pp. 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. i Kopec, B. (2021) Stability Testing of Protein Therapeutics Using DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- Kwalifikacja metody różnicowej kalorymetrii skaningowej do biofizycznej charakterystyki przeciwciał monoklonalnych (otwarty dostęp). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf