Wzór chemiczny gipsu to CaSO4 ∙ 2H2O(dwuwodny siarczan wapnia). Gips ma wiele zastosowań jako materiał budowlany.
Tynk to suchy proszek, który miesza się z wodą, tworząc pastę, która następnie twardnieje. Po wyschnięciu pozostaje dość miękki i można go łatwo obrabiać metalowymi narzędziami.
Półwodny siarczan wapnia (CaSO4 ∙ ½H2O) reaguje z wodą, tworząc dwuwodny siarczan wapnia i z powrotem Dwuwodny siarczan wapnia oddziela wodę po podgrzaniu i wymienia ją na półwodny siarczan wapnia.
Rozszczepialność krystalicznego CaSO4 ∙ 2H2Ojest spowodowana dwuwarstwami CaSO4(w każdej warstwie jony Ca2 + i SO4 2 znajdują się naprzemiennie obok siebie) o stosunkowo słabych wiązaniach wodorowych.
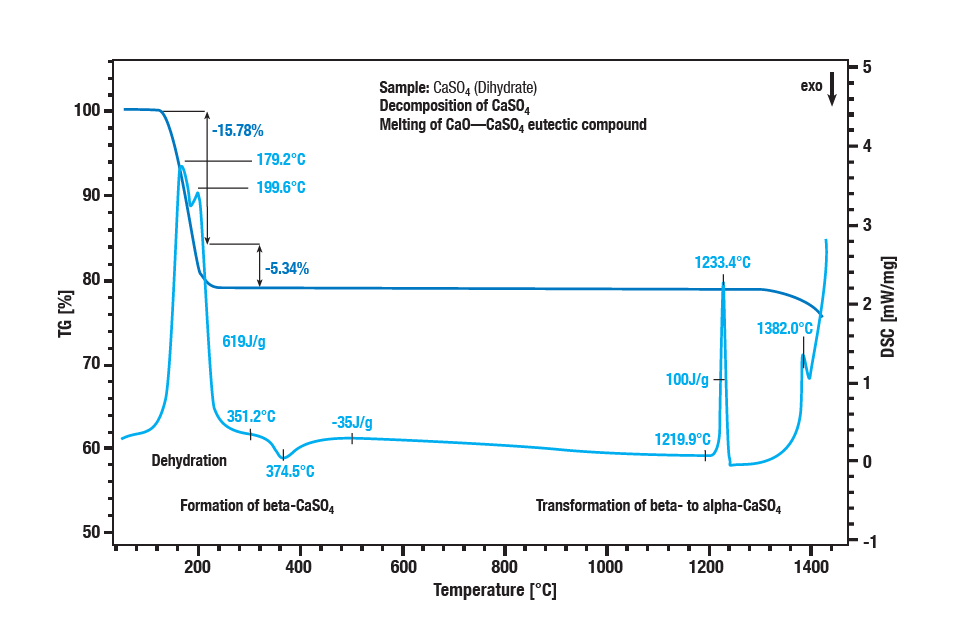
Dwuetapowa dehydratacja dwuwodnego siarczanu wapnia zachodzi w temperaturze od 100 °C do 300 °C. Pierwszym etapem jest utworzenie półwodzianu (CaSO4 ∙ 2H2Odo CaSO4 ∙ ½H2O).
Dalsze odwodnienie tworzy bezwodnik (CaSO4 ½ H2Odo CaSO 4). Z efektem egzotermicznym w temperaturze ok. 340 °C, bezwodnik przekształca się w siarczan β-wapnia. Efekt egzotermiczny na krzywej w temperaturze ok. 1220 °C to konwersja siarczanu β-wapnia w siarczan α-wapnia. Rozkład siarczanu znajduje odzwierciedlenie w dalszej utracie masy w temperaturach powyżej 1250 °C.
Siarczan wapnia jest przekształcany w tlenek wapnia. Temperatura topnienia mieszaniny eutektycznej siarczanu wapnia i tlenku wapnia wynosi 1380 °C.

