W niniejszej pracy przedstawiono wyniki pomiarów TG-DSC tetrahydratu azotanu wapnia – Ca(NO3)2.
Próbkę analizowano za pomocą urządzenia Linseis STA L82, które jednocześnie monitoruje zmianę masy i sygnał DSC. Na podstawie sygnału DSC określono entalpia entalpii przejść fazowych i pojemność cieplna można określić.
Próbkę ogrzano w zamkniętym tyglu aluminiowym do temperatury 180 °C przy szybkości ogrzewania 10 K/min i utrzymywano w stanie izotermicznym przez 3 godziny. Następnie podgrzano ją do temperatury 600 °C z szybkością 10 K/min.
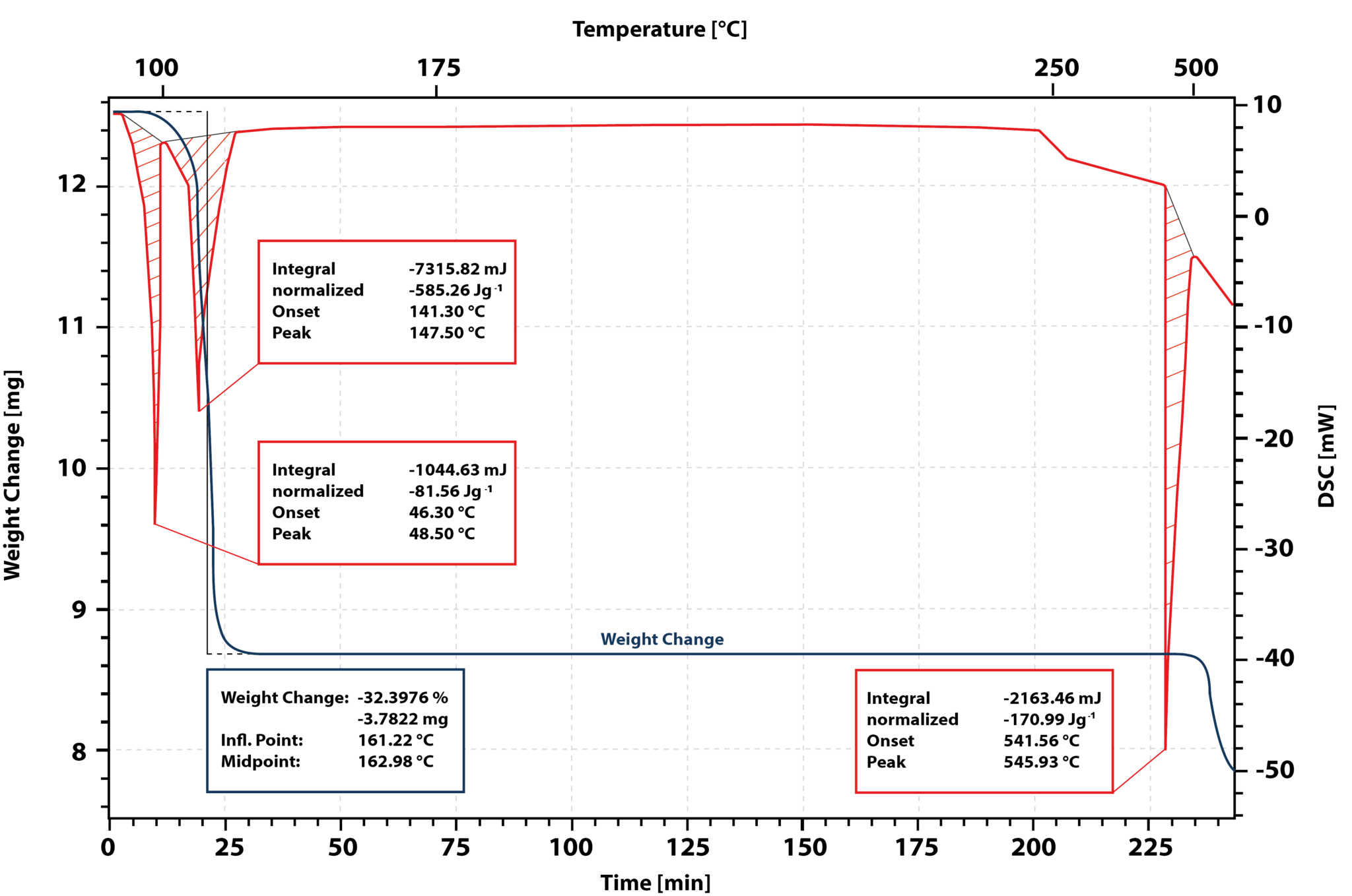
Niebieska krzywa pokazuje ubytek masy, a czerwona krzywa sygnał DSC. Pierwszy pik w sygnale DSC jest spowodowany topnieniem próbki. Początek piku topnienia ma miejsce w temperaturze 46 °C.
Po całkowitym stopieniu próbki pojawia się drugi pik endotermiczny z początkiem w temperaturze 141 °C. Sygnał TG wykazuje utratę masy o 32% w tym zakresie temperatur. Woda krystalizacyjna tetrahydratu azotanu wapnia oddziela się i powstaje stała bezwodna sól.
Podczas izotermicznego czasu utrzymywania w temperaturze 180 °C próbka nie ulega dalszym zmianom, co oznacza, że temperatura ta jest idealna do suszenia soli i uzyskania soli bezwodnej.
Po ponownym podgrzaniu do temperatury 541 °C pojawia się pik endotermiczny. Sól bezwodna topi się. Sygnał TG wykazuje jednak utratę masy. Wskazuje to, że sól rozkłada się podczas topnienia. W związku z tym nie można bezpośrednio zmierzyć entalpii topnienia i pojemności cieplnej stopionej bezwodnej soli.
Można to jednak osiągnąć poprzez dalsze pomiary TG-DSC mieszanin soli. Azotan wapnia musi być zmieszany z azotanem litu, sodu lub potasu w różnych procentach molowych. Entalpie topnienia można określić na podstawie pików topnienia DSC mieszanin. Entalpię topnienia czystego azotanu wapnia można następnie obliczyć po prostu przez ekstrapolację do procentu molowego 100% w stosunku do azotanu wapnia.
Ta sama metoda jest stosowana do pomiaru pojemności cieplnej stopionego bezwodnego azotanu wapnia.
