Vapor de agua
Mediciones de vapor de agua en el análisis térmico
Diferencia entre vapor de agua y humedad relativa en el análisis térmico
Cuando el agua se calienta hasta su punto de ebullición o superior, el agua cambia su forma agregada de líquida a gaseosa. Entonces existe como vapor de agua (vapor). Si este vapor se introduce en cualquier tipo de cámara o instrumento de reacción, se denomina aplicación de vapor de agua.
En cambio, todo gas puede transportar y contener una cierta cantidad de agua a una temperatura determinada. Esto se denomina humedad. Considerando el aire como ejemplo, siempre hay una cantidad de agua contenida en el aire, incluso por debajo del punto de ebullición del agua, que se define como grado de humedad o humedad relativa.
A diferencia de la humedad relativa, por encima del punto de ebullición dependiente de la presión, que es de 100°C en condiciones de nivel del mar, el agua sólo existe en su fase gaseosa, en forma de vapor de agua. Mezclando el vapor de agua, producido en un generador de vapor de agua, con un gas portador como el aire, el nitrógeno o el helio, se puede ajustar la concentración variable (en Vol.-%, wt.% o ppm) del vapor de agua en el gas de muestra dentro de nuestros analizadores.
Además, dependiendo de la aplicación, la atmósfera de gas dentro del dispositivo puede ser estática o dinámica. Las investigaciones típicas para las atmósferas dinámicas de vapor de agua incluyen el calentamiento isotérmico de una muestra y la posterior dosificación de una concentración definida de vapor de agua para inducir una reacción. Puede tratarse, por ejemplo, de mediciones de adsorción, desorción, reducción, oxidación o transformación.
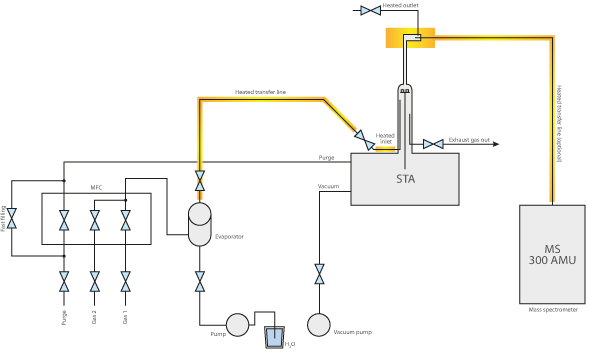
En el análisis térmico, los generadores de vapor de agua suelen utilizarse en combinación con termobalanzas como la TGA y la STA (en el rango de presión elevada), así como con dilatómetros.
Mediciones dependientes de la presión en atmósferas de vapor de agua
Además de la concentración y la temperatura, se puede controlar el nivel de presión de la atmósfera, ya que tiene una gran influencia en el experimento. Un nivel de alta presión es especialmente interesante para el cambio de las condiciones de equilibrio de las reacciones, por ejemplo, para la gasificación del carbón o de la biomasa, que puede investigarse con nuestros analizadores STA de alta presión.
Sin embargo, al aumentar el nivel de presión, hay que considerar nuevas condiciones de contorno. Por ejemplo, un aumento del nivel de presión desplaza el punto de ebullición a temperaturas más altas, hasta alcanzar el llamado punto crítico.
Por otro lado, el nivel máximo de presión del agua gaseosa viene definido por la curva de presión de vapor de saturación. Si la presión es demasiado alta, el agua se condensa. Para temperaturas o presiones más altas, por encima del punto crítico, la densidad del agua líquida es tan grande como la del agua gaseosa, por lo que ya no puede condensarse. Esto se denomina estado supercrítico, por ejemplo, vapor de agua sobrecalentado.
Para producir una atmósfera de H2O en el horno a temperaturas superiores a los 100 °C, debe utilizarse un generador de vapor de agua en combinación con nuestros sistemas. El generador evapora el agua sin mezclar necesariamente el vapor de agua residual con otros gases de purga, lo que permite una atmósfera de H2O al 100% en la muestra. No obstante, también puede diluirse añadiendo gases secos mediante MFC. La mezcla se da como concentración variable (en Vol.-%, wt.% o ppm) del vapor de agua en un gas portador seco.
¿Está interesado en un vapor de agua?
¿Necesita más información?
Póngase en contacto con nosotros hoy mismo.
Aplicaciones
El ejemplo típico de aplicaciones de vapor de agua a temperaturas y niveles de presión elevados son los experimentos de gasificación de carbón y biomasa.
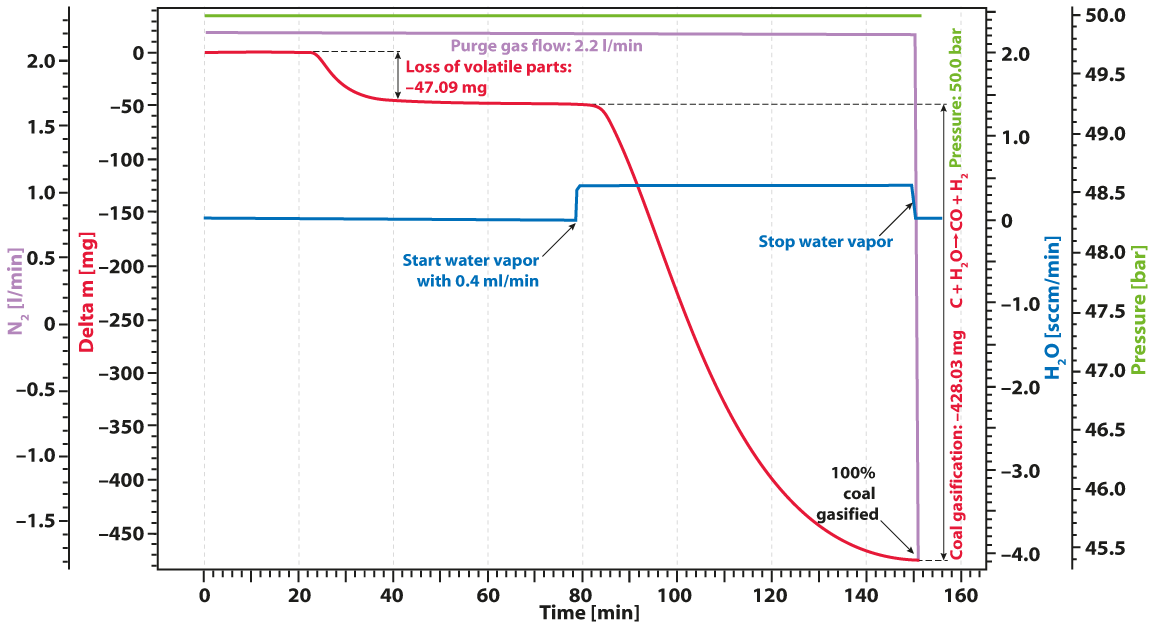
El ejemplo dado muestra un experimento típico de gasificación de carbón vegetal. La muestra de carbón se calentó hasta una meseta isotérmica bajo atmósfera de nitrógeno a 50 bares de presión (TGA de alta presión – Termobalance). La señal de masa muestra la pérdida de componentes volátiles entre 20 y 40 min. Tras la adición de vapor de agua, el carbón se gasificó y se consumió casi por completo después de 150min, dando lugar a H2, CO, CH3OH y otros gases reactivos útiles, como muestra la curva roja de pérdida de masa. Todo el proceso puede describirse así: El carbono reacciona con el vapor de agua dando lugar a una mezcla de monóxido de carbono e hidrógeno. El monóxido de carbono obtenido puede reaccionar con una segunda molécula de agua para dar lugar a dióxido de carbono e hidrógeno adicional y, finalmente, el hidrógeno resultante puede formar metano y otros hidrocarburos a partir del monóxido de carbono.