Índice
Fases de la caracterización de materiales
Los materiales pueden clasificarse y describirse de distintas formas. Esto puede hacerse, por ejemplo, basándose en su aspecto externo, en determinados parámetros físicos o incluso en impresiones más subjetivas, como el olor o el sabor.
Densidad, dureza, capacidad calorífica o conductividad
Para captar la composición química con la mayor precisión posible, se suelen describir propiedades del material que estén claramente definidas y sean medibles. Para ello se suelen utilizar constantes materiales como la densidad, la dureza, la capacidad calorífica o la conductividad. Estos valores son constantes para la mayoría de los materiales mientras la fase a la que se refieren sea estable.
Estado de la materia
Una fase suele ser una composición homogénea en la materia.
El término fase puede referirse al estado de la materia (sólido, líquido o gaseoso), pero también a la estructura de la red cristalina dentro de una zona determinada en las modificaciones sólidas o químicas.
Es importante tener en cuenta que una sustancia puede existir en distintas fases al mismo tiempo.
Determinación de las transiciones de fase
Para saber en qué fase se encuentra actualmente un material y, por tanto, cuándo se aplican qué parámetros, es especialmente importante conocer y determinar las transiciones de fase de un material. Éstas suelen producirse cuando se alcanza una determinada temperatura o nivel de energía, o bajo la influencia de la presión o de reacciones químicas.
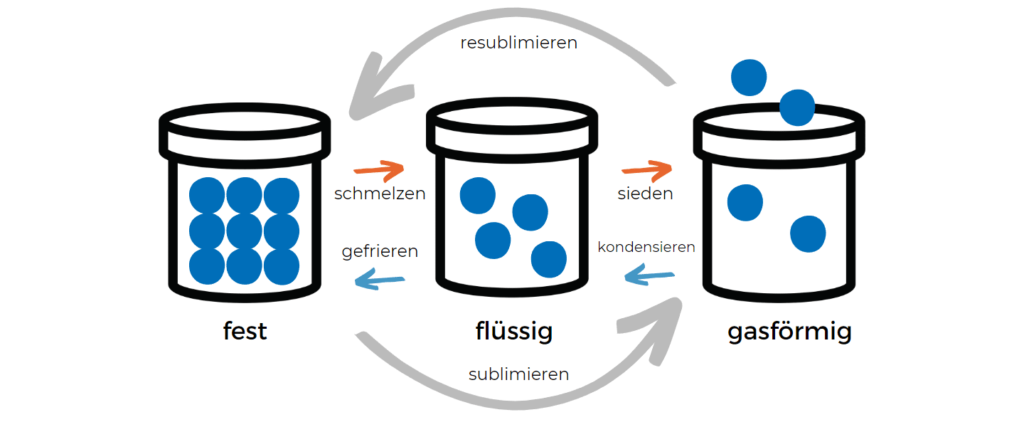
¿Qué transiciones de fase existen?
Como hay distintas definiciones de las fases (estado de la materia, estructura cristalina, modificación, etc.), también hay distintas transiciones de fase.
En el caso más sencillo, una transición de fase describe el cambio puro de un estado de la materia, por ejemplo, de sólido a líquido.
Las transiciones de fase suelen clasificarse según la llamada clasificación de Ehrenfest de Paul Ehrenfest.
En este contexto, las magnitudes termodinámicas como el volumen la entalpía o la entropía suelen considerarse en función de la temperatura.
Las transiciones de fase se dividen entonces en los llamados órdenes, donde el enésimo orden de la función de la cantidad considerada frente a la temperatura muestra una discontinuidad en la enésima derivada.
La propia función y la derivada n-ésima son continuas.
En la práctica, sólo se distinguen las transiciones de fase de 1er y 2º orden.
Ejemplos de transiciones de fase de 1er orden son:
- Transformaciones entre los estados sólido, líquido y gaseoso de la materia, en particular
- Fusión (paso de sólido a líquido)
- Evaporación (paso de líquido a gaseoso)
- Sublimación (paso de sólido a gaseoso)
- Solidificación o congelación (paso de líquido a sólido)
- Condensación (paso de gaseoso a líquido)
- Cristalización o sublimación inversa (transición de gaseoso a sólido)
Ejemplos de transiciones de fase de 2º orden son:
- Cambio entre comportamiento ferro y paramagnético a la temperatura crítica o de Curie
- Cambio entre distintos órdenes magnéticos, por ejemplo, de estructura magnética conmensurada a inconmensurada
- Cambio entre el comportamiento ferro y dieléctrico
- Transición a la superconductividad
Normalmente, en una transición de fase de 1er orden, se produce un salto en el parámetro de orden (por ejemplo, densidad, entropía, entalpía libre). En cambio, en las transiciones de fase de 2º orden, la transición en el parámetro de orden es continua. Sólo en la segunda derivada se produce un cambio brusco, por ejemplo, en la capacidad calorífica.
¿Cómo puedo medir las transiciones de fase?
Las transiciones de fase suelen medirse en el análisis térmico utilizando un Calorímetro Diferencial Dinámico DDK (en inglés Calorímetro Diferencial de Barrido – DSC).
Si una sustancia muestra una transición de fase durante la medición mediante DSC en el intervalo de temperatura medido, por ejemplo, debido a un cambio en el estado de la materia o en la estructura cristalina, esto puede observarse perfectamente mediante DSC.
La mayoría de las transiciones de fase van acompañadas de absorción (endotérmica) o liberación (exotérmica) de energía, que puede detectarse como un cambio en el flujo de calor.
El DSC mide estos cambios de temperatura mediante uno o varios termopares que están en contacto con el portamuestras, comparando así la temperatura exacta de la muestra con la temperatura ambiente y una muestra de referencia.
El flujo de calor exacto de la muestra en un momento dado puede leerse entonces a partir de la diferencia entre la referencia y la muestra.
En caso de diferencia de flujo térmico entre la muestra y la referencia, el signo de la diferencia indica si se está produciendo un proceso endotérmico o exotérmico.
La posición del efecto que se produce cuando se representa gráficamente frente a la temperatura también indica con gran precisión cuándo se produce.
Cuanto más exactamente se mida la temperatura exacta de la muestra, mejor será la resolución y la sensibilidad del DSC.
En las transiciones de fase, sobre todo en las de segundo orden, la velocidad de calentamiento es muy importante para detectar la transición.
Si la velocidad de calentamiento es demasiado lenta, los efectos suelen ser apenas detectables, ya que la diferencia de energía entre la muestra y la referencia es compensada por el horno o el calentador.
Si se calienta demasiado rápido, el efecto se hace más visible, pero también se desplaza a temperaturas más altas.
