目次
はじめにタンパク質の安定性の重要性
タンパク質の安定性を理解することは、現代の生化学、製薬研究、バイオテクノロジーの基本である。タンパク質の安定性は、治療用タンパク質が溶液中で活性を維持できる期間だけでなく、製剤化、貯蔵、輸送の適性も決定する(Wang 1999)。酵素工学から医薬品開発、構造生物学的研究に至るまで、タンパク質の安定性を正確に評価し、最適化する能力によって、研究者や技術革新者は、凝集、変性、活性喪失によるリスクを最小限に抑えながら、ライフサイエンス応用を前進させることができる。
最近の論文では、医薬品の製剤化やバイオプロセスにおけるタンパク質の安定性の役割が強調されている。そこでは、緩衝液の組成や温度がわずかに変化するだけでも、タンパク質のフォールドや治療成績に大きな影響を及ぼす可能性がある(Durowoju et al.)
タンパク質の安定性に影響を与える要因
タンパク質の機能は、その三次元構造(本来の立体構造)の完全性に決定的に依存している。この構造は様々な物理化学的要因によって乱される:
- 温度:高い温度はタンパク質をアンフォールディングさせ、不可逆的な機能喪失や凝集を引き起こす可能性がある。
- pH:pHの変化はイオン相互作用と水素結合を破壊し、構造安定性に影響を与える。
- イオン強度:塩は、荷電した側鎖との特定の相互作用によって、タンパク質を安定化させたり不安定化させたりする。
- リガンド結合:タンパク質に結合する小分子、補酵素、薬物は、特定のコンフォメーションを安定化させたり不安定化させたりする可能性がある(Durowoju et al.)
- 遺伝子変異:一点変異は安定性を高めたり低くしたりして、生理学的条件下でのタンパク質の挙動に影響を与える。
体系的な研究により、タンパク質の活性を維持するためには、取り扱い中や保存中の緩衝液の化学的性質の調整や温度管理が最も効果的な介入の一つであることが明らかになった(Wang 1999)。
基礎知識タンパク質の安定性とは何か?
タンパク質の安定性とは、様々な条件下におけるタンパク質の本来の構造の回復力を指す。それには以下のようなものがある:
- 熱力学的安定性:タンパク質が変性せずに折り畳まれた状態を維持する傾向。
- 動力学的安定性:タンパク質がアンフォールド状態または凝集状態に移行する速度。
- 可逆的変化:フォールディングの遷移の中には、穏やかな条件に戻すことで元に戻るものもある(例えば、穏やかな変性後のリフォールディング)。
- 不可逆的変化:厳しい処理(例えば、高温や化学薬品)は、元に戻せない凝集やアンフォールディングを引き起こす可能性がある。
安定性は、タンパク質集団の半分が変性する融解温度(Tm)によって定量化されることが多く、安定性アッセイで測定される重要なパラメータである(Durowoju et al.)
タンパク質の安定性を評価する方法
生体分子の安定性と相互作用を研究するために、複数の直交技術が開発されてきた。適切な手法の選択は、研究課題、タンパク質の種類、利用可能な装置によって異なる。
示差走査熱量測定 (DSC)
DSC は、タンパク質の精密な安定性研究に不可欠なツールである(Durowoju et al.) 温度が上昇するにつれてタンパク質サンプルが展開するのに必要な熱を測定することによって、DSCは決定する:
- 変性温度(Tm):熱安定性を示す。
- エンタルピーの変化(ΔH):フォールディングのエネルギー遷移を示す。
- 展開プロファイル:可逆的または不可逆的な遷移を特徴づける。
DSC は、低濃度のタンパク質であっても、微妙な遷移を正確に検出できることが評価され、変異体、熱的配合挙動、リガンドに起因する安定性シフトの特性評価に特に威力を発揮します(Qualification of a DSC Method 2020)。
その他の分析法
動的光散乱(DLS):流体力学的半径を測定し、タンパク質の凝集を検出する。熱安定性アッセイを補完する(Mirasol et al.)
紫外可視分光法:芳香族側鎖や発色団に関連する吸光度の変化を追跡することにより、アンフォールディングをモニターする。
等温滴定カロリメトリー(ITC):タンパク質とリガンド間の結合相互作用を定量化する。リガンド結合時の安定性変化の検出に有用(Durowoju et al.)
円偏光二色性(CD)分光法:フォールディングや変性時の二次構造の変化(αヘリックスからβシートへの転移など)をプローブする。
安定性に影響する相互作用の研究
タンパク質は絶えず分子環境と相互作用している。これらの相互作用が安定性にどのような影響を与えるかを評価することは、研究開発にとって不可欠である:
- リガンド結合:DSCとITCは、低分子、薬物、補因子の結合親和性と安定化または不安定化効果を測定するために使用される(Durowoju et al.)
- タンパク質の凝集:DLSは、熱やストレスにさらされた際の凝集傾向の変化を同定する(Wang 1999)。
- pH依存性:異なるpH値でDSCを行うことで、フォールディングにおけるプロトン化状態の役割に関する知見が得られる。
- 遺伝子変異体:DSCとDLSでTmや凝集プロファイルを比較することで、点変異や人工的な配列変化によってもたらされる安定性を評価することができる(Mirasolら、2021)。
熱法は分子間相互作用をいかに解明するか
のような熱技術 DSC Tmやエンタルピーが得られるだけでなく、リガンドや緩衝液の滴定プロトコルと組み合わせることで、結合親和性や構造安定化に関する深い洞察が得られる(Durowoju et al.) 例えば、タンパク質のTmを上昇させるリガンドは、薬物設計や製剤化に関連する直接的な安定化相互作用を示唆する。
実践的な洞察と測定パラメータ
タンパク質の安定性データの解釈には、実験条件と典型的な出力に注意を払う必要がある:
- 加熱速度:速度が遅いほど平衡測定に有利。
- サンプル濃度:十分な濃度により、凝集干渉のない信頼性の高いシグナルが得られます。
- 緩衝液組成:Tmとアンフォールディング・エンタルピーに対する異なる緩衝液と賦形剤の安定化効果を比較する(Wang 1999)。
- コントロールサンプル:野生型と変異型タンパク質の比較やバッファーのみの比較など、常に明確に定義された標準試料と比較する。
申し込み
アプリケーション例
- 製剤開発のためのモノクローナル抗体の安定性プロファイルの比較 (Qualification of a DSC) DSC メソッド2020)。
- 耐熱性を必要とする工業的生体触媒用の酵素変異体の評価。
- 早期創薬および構造生物学におけるタンパク質-リガンド結合親和性のスクリーニング(Durowoju et al.)
応用例リゾチームの熱変性
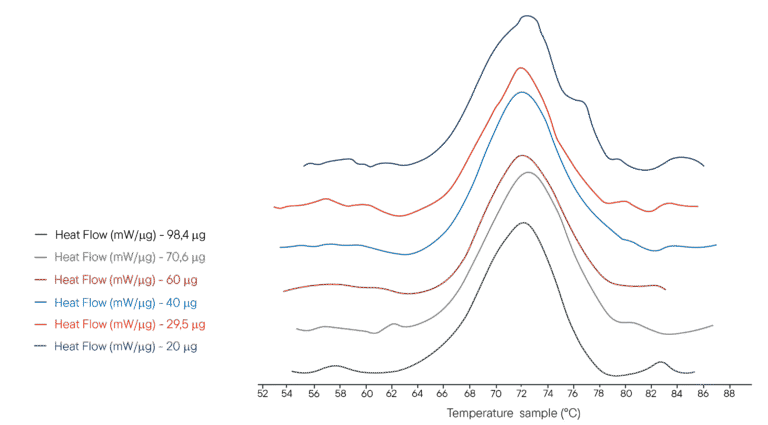
PHBバッファー中のリゾチーム溶液100µLを100µLのるつぼに入れた。異なる濃度を用い、それぞれ分析したリゾチームの質量を表した。参照用るつぼは同量のPHB緩衝液で満たした。Ultimate DSCは、40℃から95℃まで1℃/分で昇温するようにプログラムされていた。
The thermograms obtained are shown on the right.The Ultimate DSC allows the enthalpy and denaturation temperature of Lysozyme to be measured using 5 to 10 less sample than currently available instruments. Each thermogram was obtained in less than 60 minutes, allowing rapid analysis. The Ultimate DSC saves large amounts of sample and allows you to work faster.
調査に適した方法を選択する
最適な分析法の選択は、特定のタンパク質、研究目的、利用可能なリソースによって異なる:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
詳細な比較のために、最近の総説では、精密な熱量測定や分光学的測定を含む複数の技術を統合することで、タンパク質の安定性と下流用途への適合性を強固に評価できることを強調している(Mirasol et al.2021; Durowoju et al.2017)。
結論と次のステップ
参考文献
- Durowoju, I.B., Bhandal, K.S., Hu, J., Carpick, B. and Kirkitadze, M. (2017)Differential Scanning Calorimetry-A Method for Assessing Thermal Stability of Proteins, Journal of Visualized Experiments, (121), e55262.https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/.
- Wang, W. (1999) ‘Instability, stabilization, and formulation of liquid protein pharmaceuticals’,International Journal of Pharmaceutics, 185(2), pp. 129-188.https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. and Kopec, B. (2021)Stability Testing of Protein Therapeutics Using DLS,Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- モノクローナル抗体の生物物理学的特性評価のための示差走査熱量測定法の適格性評価(オープンアクセス)https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf。