جدول المحتويات
ما الفرق بين التفاعلات الماصة للحرارة والتفاعلات الطاردة للحرارة؟
يكمن الفرق الرئيسي بين التفاعلات الطاردة للحرارة والتفاعلات الماصة للحرارة في التبادل الحراري مع البيئة:
- تمتص التفاعلات الماصة للحرارة الطاقة في صورة حرارة من البيئة المحيطة بها، وهو ما يجعل البيئة المحيطة أكثر برودة. وهذا يعني أن النواتج تمتلك طاقة أكبر من المتفاعلات، ويتطلب التفاعل حرارة، وهو ما يؤدي إلى تغير موجب في الإنثالبي (ΔH).
- تطلق التفاعلات الطاردة للحرارة الطاقة إلى البيئة المحيطة في صورة حرارة، وهو ما يجعل البيئة المحيطة أكثر دفئًا. في هذه الحالة، تكون طاقة النواتج أقل من طاقة المتفاعلات ويطلق التفاعل حرارة، وهو ما يؤدي إلى تغير سالب في الإنثالبي (ΔH).
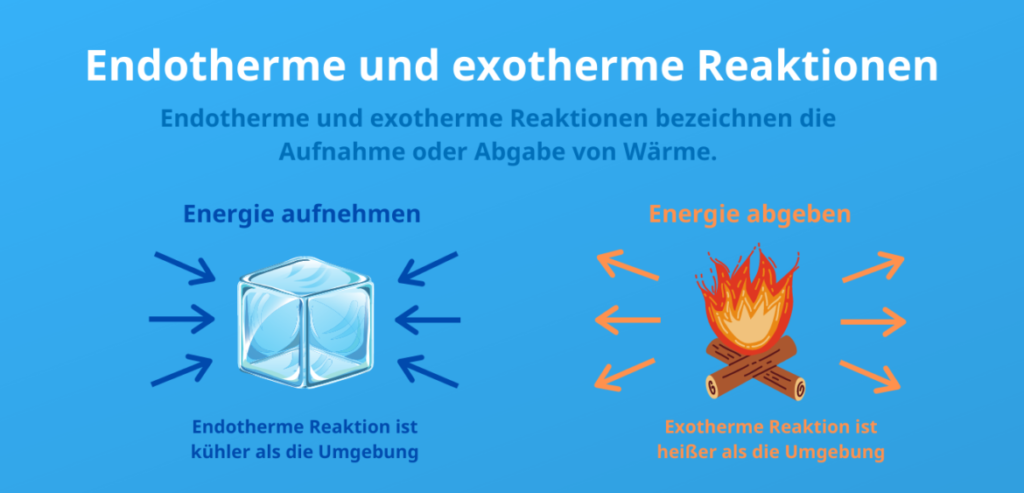
كيف يمكنك تحديد التفاعل الطارد للحرارة أو الماص للحرارة؟
هناك طريقتان للتعرف على التفاعلات الطاردة للحرارة:
- تغيّر درجة الحرارة;
- في التفاعل الطارد للحر ارة، تنطلق الطاقة، وهو ما يؤدي إلى ارتفاع درجة حرارة خليط التفاعل. في المقابل، في التفاعل الماص للحرارة، تمتص الطاقة، وهو ما يؤدي إلى انخفاض درجة الحرارة. يمكنك ملاحظة التغيرات في درجة الحرارة عن طريق وضع ترمومتر في خليط التفاعل
- التغيّر في درجة الحرارة:
- إن تغيُّر الإنثالبي (ΔH) هو الفرق بين طاقة النواتج وطاقة المتفاعلات. إذا كانت ΔH سالبة، فهذا يعني أنه تفاعل كيميائي طارد للحرارة لأن الطاقة المنطلقة عند تكون النواتج أكبر من الطاقة المستخدمة في تكسير المتفاعلات. أما إذا كانت ΔH موجبة، فهو تفاعل كيميائي ماص للحرارة لأن الطاقة المنطلقة عند تكوُّن النواتج أقل من الطاقة المستخدمة في تفكيك المتفاعلات.
التفاعلات الطاردة للحرارة والماصة للحرارة لها تأثيرات مختلفة على البيئة:
وتطلق التفاعلات الطاردة للحرارة الحرارة في البيئة، والتي يمكن أن يكون لها تأثيرات بيئية إيجابية وسلبية على حد سواء. على سبيل المثال، تشارك هذه التفاعلات في عمليات مثل التنفس والاحتراق وإنتاج الطاقة. ومع ذلك، يمكن أن تساهم التفاعلات الطاردة للحرارة أيضًا في المشاكل البيئية مثل تلوث الهواء والماء.
أمثلة أخرى على التفاعلات الطاردة للحرارة:
- حرق الخشب أو الفحم:
- عند حرق الخشب أو الفحم، تنبعث حرارة طاردة للحرارة. وتستخدم هذه التفاعلات في أنظمة التدفئة والأفران والمحركات لتوليد الطاقة.
- أكسدة المعادن:
- عندما تتفاعل الفلزات مع الأكسجين، مثل الحديد، لتكوين الصدأ، يكون تفاعلًا طاردًا للحرارة حيث تنطلق الحرارة.
- المتفجرات الكيميائية:
- إن الانفجارات في المتفجرات الكيميائية هي تفاعلات طاردة للحرارة حيث يتم إطلاق كميات كبيرة من الطاقة في شكل حرارة وضغط.
تمتص التفاعلات الماصة للحرارة الحرارة من البيئة. وعلى الرغم من أنها ضرورية لعمليات مثل البناء الضوئي والطبخ، إلا أن تأثيرها المباشر على البيئة أقل عموماً مقارنة بالتفاعلات الطاردة للحرارة.
أمثلة أخرى على التفاعلات الماصة للحرارة:
- البناء الضوئي:
- في عملية البناء الضوئي، تمتص النباتات ثاني أكسيد الكربون من الهواء وتحوله إلى سكر وأكسجين باستخدام الطاقة الضوئية. وهذا تفاعل ماص للحرارة، حيث يتم امتصاص الطاقة في صورة ضوء
- الماء المغلي:
- تسخين الماء حتى الغليان هو تفاعل ماص للحرارة. أثناء عملية الغليان، تضاف الطاقة في شكل حرارة لتحويل جزيئات الماء إلى بخار.
- محلول الملح في الماء:
- عندما يذوب الملح في الماء، تمتص جزيئات الملح الحرارة من البيئة المحيطة لتفتيت البلورات وتنتشر في صورة ذائبة.