جدول المحتويات
مقدمة: أهمية استقرار البروتين
يُعد فهم ثبات البروتين أمرًا أساسيًا للكيمياء الحيوية الحديثة والبحوث الصيدلانية والتكنولوجيا الحيوية. لا يحدد ثبات البروتين ليس فقط المدة التي يمكن أن يظل فيها البروتين العلاجي نشطًا في المحلول ولكن أيضًا مدى ملاءمته للتركيب والتخزين والنقل (وانج 1999). ومن هندسة الإنزيمات إلى تطوير الأدوية ودراسات البيولوجيا الهيكلية، فإن القدرة على التقييم الدقيق لثبات البروتين وتحسينه تمكن الباحثين والمبتكرين من تطوير تطبيقات علوم الحياة مع تقليل المخاطر الناجمة عن التجميع أو تغيير طبيعة البروتين أو فقدان النشاط.
تؤكد المنشورات الحديثة على دور ثبات البروتين في تركيب الأدوية والمعالجة الحيوية – حيث يمكن أن تؤثر حتى التغييرات الطفيفة في تركيبة المخزن المؤقت أو درجة الحرارة تأثيرًا عميقًا على ثبات البروتين والنتائج العلاجية (دوروجو وآخرون 2017).
العوامل التي تؤثر على استقرار البروتين
تعتمد وظيفة البروتين اعتمادًا حاسمًا على سلامة بنيته ثلاثية الأبعاد – أي التشكل الأصلي. ويمكن أن تتأثر هذه البنية بمجموعة متنوعة من العوامل الفيزيائية الكيميائية:
- درجة الحرارة: قد تؤدي درجات الحرارة المرتفعة إلى كشف البروتينات، مما يتسبب في فقدان الوظيفة أو التكتل بشكل لا رجعة فيه.
- الأس الهيدروجيني: تؤدي التغييرات في الأس الهيدروجيني إلى تعطيل التفاعلات الأيونية والروابط الهيدروجينية، مما يؤثر على الاستقرار الهيكلي.
- القوة الأيونية: يمكن للأملاح تثبيت البروتينات أو زعزعة استقرارها اعتمادًا على تفاعلات محددة مع السلاسل الجانبية المشحونة.
- الارتباط بالليجند: قد تعمل الجزيئات الصغيرة أو العوامل المساعدة أو الأدوية التي ترتبط بالبروتينات على تثبيت أو زعزعة استقرار تشكيلات محددة (Durowoju et al. 2017).
- الطفرات الوراثية: قد تؤدي الطفرات أحادية النقطة إلى تعزيز الاستقرار أو تقليله، مما يؤثر على سلوك البروتين في ظل الظروف الفسيولوجية.
وتكشف الدراسات المنهجية أن تعديل كيمياء المواد العازلة والتحكم في درجة الحرارة أثناء المناولة والتخزين من بين التدخلات الأكثر فعالية للحفاظ على نشاط البروتين (وانغ 1999).
الأساسيات: ماذا يعني استقرار البروتين؟
يشير استقرار البروتين إلى مرونة البنية الأصلية للبروتين في ظل ظروف مختلفة. ويشمل ذلك:
- الاستقرار الديناميكي الحراري: ميل البروتين إلى البقاء مطويًا بدلًا من تغيير طبيعته.
- الاستقرار الحركي: المعدل الذي ينتقل به البروتين إلى الحالة غير المطوية أو المتجمعة.
- التغييرات القابلة للعكس: يمكن عكس بعض تحولات الطي عن طريق استعادة الظروف الحميدة (على سبيل المثال، إعادة الطي بعد تغيير طفيف في طبيعة المادة).
- تغيرات لا يمكن عكسها: قد تؤدي المعالجة الشديدة (على سبيل المثال، درجات الحرارة المرتفعة أو العوامل الكيميائية) إلى تجميع أو انكشاف لا يمكن عكسه.
وغالبًا ما يتم قياس الثبات من خلال درجة حرارة الانصهار (Tm)، والتي يتم عندها تغيير طبيعة نصف مجموعة البروتين – وهو معيار رئيسي يُقاس في مقايسات الثبات (Durowoju وآخرون 2017).
طرق تقييم استقرار البروتين
تم تطوير تقنيات متعامدة متعددة لدراسة الاستقرار والتفاعلات الجزيئية الحيوية. يعتمد اختيار الطريقة المناسبة على سؤال البحث ونوع البروتين والأجهزة المتاحة.
المسح الحراري التفاضلي (DSC)
DSC أداة أساسية لدراسات الاستقرار الدقيقة في البروتينات (Durowooju et al. 2017). من خلال قياس الحرارة اللازمة لفتح عينة من البروتين مع زيادة درجة الحرارة، يحدد DSC:
- درجة حرارة التغيّر (Tm): يشير إلى الاستقرار الحراري.
- تغيرات الطاقة الحرارية (ΔH): يكشف عن انتقالات طاقة الطي.
- كشف الملامح: تمييز التحولات القابلة للانعكاس أو غير القابلة للانعكاس.
DSC لدقتها في الكشف عن التحولات الدقيقة – حتى بالنسبة للبروتينات بتركيزات منخفضة – وهي قوية بشكل خاص في توصيف المتغيرات وسلوك التركيب الحراري وتحولات الاستقرار الناجمة عن الروابط (تأهيل طريقة DSC 2020).
طرق تحليلية أخرى
التشتت الضوئي الديناميكي (DLS): يقيس نصف القطر الهيدروديناميكي ويكشف عن تجمع البروتين، ويكمل الاستقرار الحراري (ميراسول وآخرون 2021).
التحليل الطيفي بالأشعة فوق البنفسجية والمرئية: يراقب الانكشاف عن طريق تتبع التغيرات في الامتصاصية المتعلقة بالسلاسل الجانبية العطرية أو الكروموفورات.
كالوريمترية المعايرة المتساوية الحرارة (ITC): يقيس تفاعلات الارتباط بين البروتينات والروابط؛ وهو مفيد للكشف عن التغيرات في الثبات عند ارتباط الروابط (دوروجو وآخرون 2017).
التحليل الطيفي للثنائية الدائرية (CD): يتحرى تغيرات البنية الثانوية أثناء الطي أو التمسخ (على سبيل المثال، التحولات من لولب ألفا إلى صفائح بيتا).
دراسة التفاعلات التي تؤثر على الاستقرار
تتفاعل البروتينات باستمرار مع بيئتها الجزيئية. ويعد تقييم كيفية تأثير هذه التفاعلات على استقرارها أمراً ضرورياً للبحث والتطوير:
- الارتباط بالليجند: يُستخدم DSC وITC لتحديد تقارب الارتباط والتأثيرات المثبتة أو المزعزعة للاستقرار للجزيئات الصغيرة والأدوية والعوامل المساعدة (دوروجو وآخرون 2017)
- تراكم البروتين: يحدد DLS التغيرات في الميل إلى التجميع أثناء التعرض للحرارة أو الإجهاد (وانغ 1999).
- الاعتماد على الأس الهيدروجيني: من خلال إجراء عمليات تذبذب الأُس الهيدروجيني عند قيم أس هيدروجيني مختلفة، يكتسب الباحثون رؤى حول دور حالات البروتونات في عملية الطي.
- المتغيرات الجينية: تسمح المقارنة بين سمات Tm أو التجميع عن طريق DSC وDLS بتقييم الثبات الذي تمنحه الطفرات النقطية أو التغييرات التسلسلية المهندسة (Mirasol وآخرون 2021).
كيف تضيء الطرق الحرارية التفاعلات الجزيئية
التقنيات الحرارية مثل DSC لا تنتج فقط Tm و الإنثالبي – ولكن عند دمجها مع بروتوكولات معايرة الروابط أو المخازن المؤقتة، فإنها توفر رؤى عميقة حول تقارب الارتباط والاستقرار الهيكلي (Durowoju et al. 2017). على سبيل المثال، يشير الرابط الذي يزيد من Tm للبروتين إلى تفاعل استقرار مباشر ذي صلة بتصميم الدواء أو تركيبته.
الرؤى العملية ومعلمات القياس
يتطلب تفسير بيانات ثبات البروتين الانتباه إلى الظروف التجريبية والمخرجات النموذجية:
- معدل التسخين: يؤثر على الكشف عن الثبات الحركي مقابل الكشف عن الثبات الديناميكي الحراري؛ المعدلات الأبطأ تفضل قياسات التوازن.
- تركيز العينة: يضمن التركيز الكافي إشارة موثوقة دون تداخل في التجميع.
- تركيبة المخزن المؤقت: مقارنة التأثيرات المثبتة للمخازن المؤقتة والسواغات المختلفة على Tm و إنثالبي التكشف (Wang 1999).
- عينات التحكم: قارن دائمًا بمعايير محددة جيدًا – مثل النوع البري مقابل البروتينات الطافرة أو ضوابط المخزن المؤقت فقط.
التطبيق
أمثلة على التطبيقات
- مقارنة ملامح ثبات الأجسام المضادة وحيدة النسيلة لتطوير التركيبات (تأهيل DSC طريقة 2020).
- تقييم متغيرات الإنزيمات للتحفيز الحيوي الصناعي الذي يتطلب مرونة حرارية.
- فحص تقاربات الارتباط بين البروتين والرباط في اكتشاف الأدوية في المراحل المبكرة من اكتشاف الأدوية والبيولوجيا الهيكلية (دوروجو وآخرون 2017).
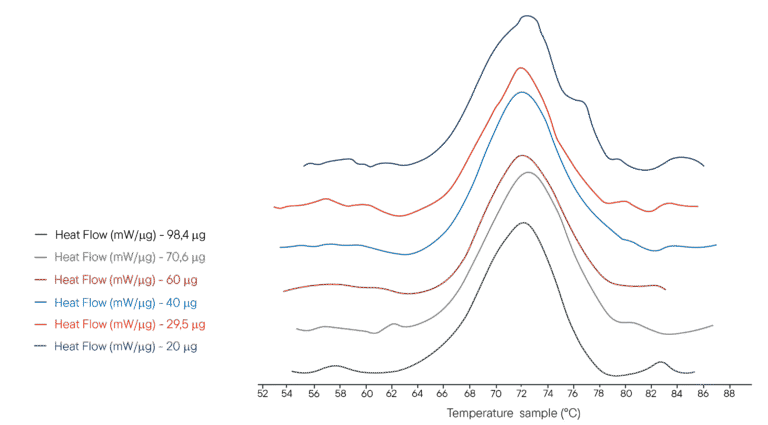
مثال تطبيقي: المسخ الحراري لليزوزيم
100µL of several solutions of lysozyme in PHB buffer were placed in a 100µL crucible. Different concentrations were used, representing different masses of lysozyme analysed respectively. The reference crucible was filled with the same volume of PHB buffer. The Ultimate DSC was programmed to perform a temperature ramp from 40°C to 95°C at 1°C/min.
وتظهر المخططات الحرارية التي تم الحصول عليها على اليمين.يسمح جهاز DSC النهائي بقياس درجة حرارة الإنثالبي ودرجة حرارة تمسخ الليزوزيم باستخدام عينة أقل من 5 إلى 10 عينات من الأدوات المتاحة حاليًا. تم الحصول على كل مخطط حراري في أقل من 60 دقيقة، مما يسمح بالتحليل السريع. يوفر جهاز Ultimate DSC كميات كبيرة من العينة ويتيح لك العمل بشكل أسرع.
اختيار الطريقة المناسبة لبحثك
يعتمد اختيار الطريقة التحليلية المثلى على البروتين المحدد وهدف البحث والموارد المتاحة:
| Method | Key Insights | Typical Applications |
|---|---|---|
| DSC | Tm, ΔH, unfolding profile | Formulation, variant screening, stability assays |
| DLS | Aggregation, size distribution | Formulation, quality control, aggregation analysis |
| ITC | Binding affinity, thermodynamics | Drug design, ligand screening, protein-protein interactions |
| CD-Spectroscopy | Secondary structure change | Conformational studies, denaturation monitoring |
| UV/Vis Spectroscopy | Folding/unfolding, aggregation | Quick screening, routine assay |
للمقارنة التفصيلية، تسلط المراجعات الحديثة الضوء على كيفية دمج تقنيات متعددة، بما في ذلك القياسات المسعرية والطيفية الدقيقة، مما يؤدي إلى تقييم قوي لثبات البروتين وملاءمته للتطبيقات النهائية (Mirasol وآخرون 2021؛ Durowooju وآخرون 2017).
الخاتمة والخطوات التالية
يُعد فهم ثبات البروتين والتحكم فيه أمرًا أساسيًا لنجاح أبحاث الجزيئات الحيوية والتركيبات الصيدلانية وتطوير الأدوية. يوفر التحليل الحراري، خاصةً باستخدام DSC، رؤى قوية وقابلة للقياس الكمي حول سلوك البروتين في ظل الظروف العملية، مما يساعدك على اتخاذ قرارات مستندة إلى البيانات بثقة.
إذا كنت تسعى إلى تطوير تحقيقاتك في استقرار البروتين، فإن جهاز Linseis UDSC L64 يوفر أحدث ما توصلت إليه المسعرات الحرارية مصممة خصيصًا لتحليل الجزيئات الحيوية وتطوير التركيبات. اكتشف المزيد حول أداء جهاز UDSC L64 وطيف التطبيقات المتنوعة على صفحة حلول المسعرات الحرارية لدينا، أو تواصل مع فريقنا المتخصص للحصول على استشارة فردية فيما يتعلق باحتياجاتك البحثية.
مؤلفات مختارة للمزيد من القراءة
- Durowooju, I.B., Bhandal, K.S., Hu, J., Carpick, B. and Kirkitadze, M. (2017) المسح التفاضلي للمساح الحراري للمساواة – طريقة لتقييم الاستقرار الحراري للبروتينات، مجلة التجارب المرئية، (121), e55262. https://pmc.ncbi.nlm.nih.gov/articles/PMC5409303/
- وانغ، و. (1999) “عدم استقرار وتثبيت وصياغة المستحضرات الصيدلانية البروتينية السائلة”، المجلة الدولية للصيدلة، 185(2)، ص 129-188. https://doi.org/10.1016/S0378-5173(99)00152-0
- Mirasol, F., Wypych, J. and Kopec, B. (2021) اختبار ثبات العلاجات البروتينية باستخدام DLS, Pharmaceutical Technology. https://www.pharmtech.com/view/stability-testing-of-protein-therapeutics-using-dls
- تأهيل طريقة المسح الضوئي التفاضلي للقياس الحراري التفاضلي للتوصيف الفيزيائي الحيوي للأجسام المضادة أحادية النسيلة (الوصول المفتوح). https://www.openaccessjournals.com/articles/qualification-of-a-differential-scanning-calorimetry-method-for-biophysical-characterization-of-monoclonal-antibodies-an.pdf