Plâtre (sulfate de calcium dihydraté)
Introduction et application
La formule chimique du gypse est CaSO4 ∙ 2H2O (sulfate de calcium dihydraté). Le gypse comme matériau de construction peut être utilisé à de nombreuses fins. Le gypse est une poudre sèche qui est mélangée à de l’eau pour former une pâte qui durcit ensuite. Il reste assez mou après le séchage et peut être facilement manipulé avec des outils métalliques. Le sulfate de calcium demi-hydraté (CaSO4 ∙ ½H2O) réagit avec l’eau en sulfate de calcium dihydraté et en amont en sulfate de calcium dihydraté.
sépare l’eau sous chauffage et l’échange en sulfate de calcium mi-hydraté. La fissilité du CaSO4 ∙ 2H2O cristallin est causée par des couches doubles de CaSO4 (dans chaque couche se trouvent alternativement des couches de Ca2+- et de SO4 2-Ioniques côte à côte) avec des ponts relativement faibles en hydrogène.
Analyse à l’aide de STA
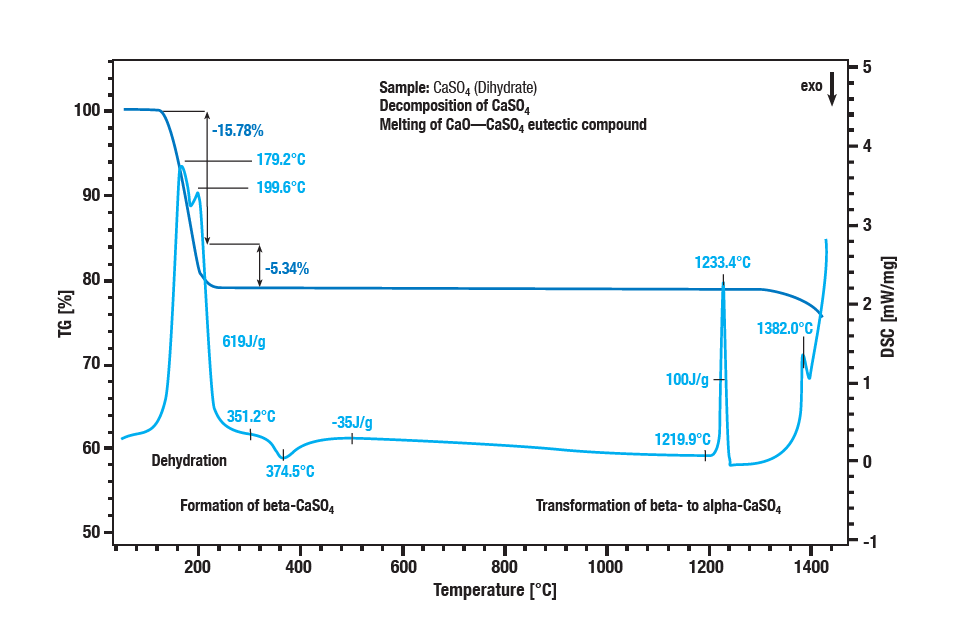
La déshydratation en deux étapes du sulfate de calcium dihydraté apparaît entre 100°C et 300°C. La première étape est la formation de demi-hydrate (CaSO4 ∙ 2H2O à CaSO4 ∙ ½H2O). Une déshydratation supplémentaire forme l’anhydrate (CaSO4 ∙ ½H2O ½H2O à CaSO4). Avec un effet exothermique à environ 340°C, l’anhydrate se transforme en β-sulfate de calcium. L’effet exothermique dans la courbe à environ 1220°C est la conversion du sulfate de calcium β en sulfate de calcium α. La décomposition du sulfate se traduit par une perte de masse supplémentaire à des températures supérieures à 1250°C. Le sulfate de calcium se transforme en oxyde de calcium. La fusion d’un mélange eutectique de sulfate de calcium et d’oxyde de calcium est le pic à 1380°C.